С чем реагирует пентан
Пентан, свойства, химические реакции
Пентан, свойства, химические реакции.
Пентан, C5H12 – органическое вещество класса алканов. В природе содержится в природном газе, добываемом из газовых и газоконденсатных месторождений, в попутном нефтяном газе, в нефти.
Пентан, формула, газ, характеристики:
Пентан – органическое вещество класса алканов, состоящий из пяти атомов углерода и двенадцати атомов водорода. Название происходит от корня «пент-» (в переводе с древне-греческого «πέντε» – пять) и суффикса «-ан» (что означает принадлежность к алканам).
Химическая формула пентана C5H12. Имеет три изомера: н-пентан, изопентан (2-метилбутан) и неопентан (2,2-диметилпропан). Изомеры пентана различаются между собой по своим физическим свойствам.
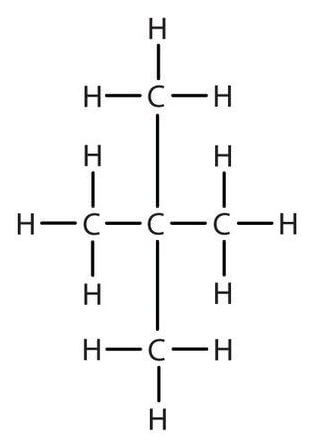
Строение молекулы н-пентана:
Строение молекулы изопентана:
Строение молекулы неопентана:
Н-пентан – легколетучая подвижная горючая жидкость с характерным запахом.
Изопентан – легколетучая подвижная горючая жидкость с характерным запахом.
Неопентан – бесцветный газ, без вкуса, со специфическим характерным запахом.
Пожаро- и взрывоопасен.
Мало растворяется в воде. Растворяется в органических веществах (ацетон, бензол, хлороформ, диэтиловый эфир и другие).
Пентан по токсикологической характеристике относится к веществам 3-го класса опасности (умеренно опасным веществам) по ГОСТ 12.1.007.
Физические свойства пентана:
| Наименование параметра: | Значение: |
| Цвет | без цвета |
| Запах | специфический характерный запах |
| Вкус (неопентан) | без вкуса |
| Агрегатное состояние н-пентана (при 20 °C и атмосферном давлении 1 атм.) | жидкость |
| Агрегатное состояние изопентана (при 20 °C и атмосферном давлении 1 атм.) | жидкость |
| Агрегатное состояние неопентана (при 20 °C и атмосферном давлении 1 атм.) | газ |
| Плотность н-пентана (при 20 °C и атмосферном давлении 1 атм.), кг/м 3 | 626 |
| Плотность изопентана (при 20 °C и атмосферном давлении 1 атм.), кг/м 3 | 619,7 |
| Плотность неопентана (при 0 °C и атмосферном давлении 1 атм.), кг/м 3 | 613 |
| Температура плавления н-пентана, °C | -129,72 |
| Температура плавления изопентана, °C | -159,89 |
| Температура плавления неопентана, °C | -16,55 |
| Температура кипения н-пентана, °C | 36,07 |
| Температура кипения изопентана, °C | 27,85 |
| Температура кипения неопентана, °C | 9,5 |
| Температура самовоспламенения н-пентана, °C | 309 |
| Критическая температура н-пентана*, °C | 196,62 |
| Критическая температура изопентана, °C | 187,39 |
| Критическая температура неопентана, °C | 160,75 |
| Критическое давление н-пентана, МПа | 3,369 |
| Критическое давление изопентана, МПа | 3,381 |
| Критическое давление неопентана, МПа | 3,199 |
| Критический удельный объём н-пентана, м 3 /кг | 231,9 |
| Критический удельный объём изопентана, м 3 /кг | 234 |
| Критический удельный объём неопентана, м 3 /кг | 237,7 |
| Взрывоопасные концентрации смеси газа н-пентана с воздухом, % объёмных | от 1,5 до 7,8 |
| Удельная теплота сгорания н-пентана, МДж/кг | 45,38 |
| Молярная масса н-пентана, г/моль | 72,15 |
* при температуре выше критической температуры газ невозможно сконденсировать ни при каком давлении.
Химические свойства пентана:
Химические свойства пентана аналогичны свойствам других представителей ряда алканов. Поэтому для него характерны аналогичные химические реакции.
Примечание: © Фото //www.pexels.com, //pixabay.com
Мировая экономика
Справочники
Востребованные технологии
Поиск технологий
О чём данный сайт?
Настоящий сайт посвящен авторским научным разработкам в области экономики и научной идее осуществления Второй индустриализации России.
Он включает в себя:
– экономику Второй индустриализации России,
– теорию, методологию и инструментарий инновационного развития – осуществления Второй индустриализации России,
– организационный механизм осуществления Второй индустриализации России,
– справочник прорывных технологий.
Мы не продаем товары, технологии и пр. производителей и изобретателей! Необходимо обращаться к ним напрямую!
Мы проводим переговоры с производителями и изобретателями отечественных прорывных технологий и даем рекомендации по их использованию.
О Второй индустриализации
Осуществление Второй индустриализации России базируется на качественно новой научной основе (теории, методологии и инструментарии), разработанной авторами сайта.
Конечным результатом Второй индустриализации России является повышение благосостояния каждого члена общества: рядового человека, предприятия и государства.
Вторая индустриализация России есть совокупность научно-технических и иных инновационных идей, проектов и разработок, имеющих возможность быть широко реализованными в практике хозяйственной деятельности в короткие сроки (3-5 лет), которые обеспечат качественно новое прогрессивное развитие общества в предстоящие 50-75 лет.
Та из стран, которая первой осуществит этот комплексный прорыв – Россия, станет лидером в мировом сообществе и останется недосягаемой для других стран на века.
Пентан, свойства, химические реакции
Пентан, свойства, химические реакции.
Пентан, C5H12 — органическое вещество класса алканов. В природе содержится в природном газе, добываемом из газовых и газоконденсатных месторождений, в попутном нефтяном газе, в нефти.
Пентан, формула, газ, характеристики:
Пентан — органическое вещество класса алканов, состоящий из пяти атомов углерода и двенадцати атомов водорода. Название происходит от корня «пент-» (в переводе с древне-греческого «πέντε» — пять) и суффикса «-ан» (что означает принадлежность к алканам).
Химическая формула пентана C5H12. Имеет три изомера: н-пентан, изопентан (2-метилбутан) и неопентан (2,2-диметилпропан). Изомеры пентана различаются между собой по своим физическим свойствам.
Строение молекулы н-пентана:
Строение молекулы изопентана:
Строение молекулы неопентана:
Н-пентан — легколетучая подвижная жидкость с характерным запахом.
Изопентан — легколетучая подвижная жидкость с характерным запахом.
Неопентан – бесцветный газ, без вкуса, со специфическим характерным запахом.
Пожаро- и взрывоопасен.
Мало растворяется в воде. Растворяется в органических веществах (ацетон, бензол, хлороформ, диэтиловый эфир и другие).
Токсичен. Изопентан обладает наркотическим действием. Класс опасности четвертый.
Физические свойства пентана:
| Наименование параметра: | Значение: |
| Цвет | без цвета |
| Запах | специфический характерный запах |
| Вкус | без вкуса |
| Агрегатное состояние н-пентана (при 20 °C и атмосферном давлении 1 атм.) | жидкость |
| Агрегатное состояние изопентана (при 20 °C и атмосферном давлении 1 атм.) | жидкость |
| Агрегатное состояние неопентана (при 20 °C и атмосферном давлении 1 атм.) | газ |
| Плотность н-пентана (при 20 °C и атмосферном давлении 1 атм.), кг/м 3 | 626 |
| Плотность изопентана (при 20 °C и атмосферном давлении 1 атм.), кг/м 3 | 619,7 |
| Плотность неопентана (при 0 °C и атмосферном давлении 1 атм.), кг/м 3 | 613 |
| Температура плавления н-пентана, °C | -129,72 |
| Температура плавления изопентана, °C | -159,89 |
| Температура плавления неопентана, °C | -16,55 |
| Температура кипения н-пентана, °C | 36,07 |
| Температура кипения изопентана, °C | 27,85 |
| Температура кипения изопентана, °C | 9,5 |
| Температура самовоспламенения н-пентана, °C | 309 |
| Критическая температура н-пентана*, °C | 196,62 |
| Критическая температура изопентана, °C | 187,39 |
| Критическая температура неопентана, °C | 160,75 |
| Критическое давление н-пентана, МПа | 3,369 |
| Критическое давление изопентана, МПа | 3,381 |
| Критическое давление неопентана, МПа | 3,199 |
| Критический удельный объём н-пентана, м 3 /кг | 231,9 |
| Критический удельный объём изопентана, м 3 /кг | 234 |
| Критический удельный объём неопентана, м 3 /кг | 237,7 |
| Взрывоопасные концентрации смеси газа н-пентана с воздухом, % объёмных | от 1,5 до 7,8 |
| Удельная теплота сгорания н-пентана, МДж/кг | 45,38 |
| Малярная масса н-пентана, г/моль | 72,15 |
* при температуре выше критической температуры газ невозможно сконденсировать ни при каком давлении.
Химические свойства пентана:
Химические свойства пентана аналогичны свойствам других представителей ряда алканов. Поэтому для него характерны аналогичные химические реакции.
Примечание: © Фото https://www.pexels.com, https://pixabay.com
РЕКОМЕНДАЦИИ ПО ИСПОЛЬЗОВАНИЮ ТЕХНОЛОГИЙ
либо воспользуйтесь поиском аналогов технологий:
или пиши нам здесь…
С чем взаимодействует пентан?
С чем взаимодействует пентан?
В общем, формула пентана не маленькая, поэтому покажу реакции на метане, НО, для пентана будет характерно то же самое.
В каком месте будет стоять кратная связь, Вам выбирать) ;
Е образование арена, в данном случае циклопентана) ;
Что касается каталического окисления, то я думаю, что там будет образовываться смесь карбоновых кислот, таких как пропионоая, уксусная + смеси газов CO2 и CO, поэтму реакцию весьма затруднительно написать, учитвая эти продукты.
Составить уравнение реакций : горение пентана, крекинг гесана, дегедрирование этана, изомеризация гептана?
Составить уравнение реакций : горение пентана, крекинг гесана, дегедрирование этана, изомеризация гептана.
Напишите реакцию галогенирования (замещения ) пентана на хлором на свету назовите продукты реакций?
Напишите реакцию галогенирования (замещения ) пентана на хлором на свету назовите продукты реакций.
Уравнение реакции получение водорода Zn + H2SO4?
Уравнение реакции получение водорода Zn + H2SO4.
Уравнение реакции горение водорода.
Уравнение реакции взаимодействия с CuO.
Предложите несколько методов добывания пентана из алюминий карбида?
Предложите несколько методов добывания пентана из алюминий карбида.
Напишите уравнения реакций.
Помогите пожалуйста : ) Чему равен коэффициент перед формулой кислорода в уравнении полного сгорания пентана?
Помогите пожалуйста : ) Чему равен коэффициент перед формулой кислорода в уравнении полного сгорания пентана.
? Напишите уравнение этой реакции.
Напишите реакцию горения пентана?
Напишите реакцию горения пентана.
Какой объем углекислого газа выделится при сжигании 7, 2 г пентана.
Напишите 5 уравнений реакций, характеризующие химические свойства алканов на примере пентана?
Напишите 5 уравнений реакций, характеризующие химические свойства алканов на примере пентана.
Как получить углекислый газ из пентана?
Как получить углекислый газ из пентана.
Алканы
Органическая химия
По мере изучения вы поймете, что свойства вещества определяются его строением, и научитесь легко предсказывать ход реакций 😉
Номенклатура алканов
Гомологами называют вещества, сходные по строению и свойствам, отличающиеся на одну или более групп CH2
Названия алканов формируются по нескольким правилам. Если вы знаете их, можете пропустить этот пункт, однако я должен познакомить читателя с ними. Итак, алгоритм составления названий следующий:
Внимательно изучите составленные для различных веществ названия ниже.
В углеводородной цепочке различают несколько типов атомов углерода, в зависимости от того, с каким числом других атомов углерода соединен данный атом. Различают первичные, вторичные, третичные и четвертичные атомы углерода.
Изомерия бывает структурной (межклассовая, углеродного скелета, положения функциональной группы или связи) и пространственной (геометрической, оптической). По мере изучения классов органических веществ вы узнаете о всех этих видах.
В молекулах алканов отсутствуют функциональные группы, кратные связи. Для алканов возможна изомерия только углеродного скелета. Так у пентана C5H12 существует 3 структурных изомера.
Природный газ и нефть
В состав нефти входят алканы с длинными углеродными цепочками, например: C8H18, C12H26. Путем крекинга из нефти получают алканы.
Получение алканов
В ходе крекинга нефти получается один алкан и один алкен.
Данный синтез заключается в сплавлении соли карбоновой кислоты с щелочью, в результате образуется алкан.
Эта реакция заключается во взаимодействии галогеналкана с металлическим натрием, калием или литием. В результате происходит удвоение углеводородного радикала, рост цепи осуществляется зеркально: в том месте, где находился атом галогена.
В ходе синтеза Гриньяра с помощью реактива Гриньяра (алкилмагнийгалогенида) получают различные органические соединения, в том числе несимметричные (в отличие от реакции Вюрца).
На схеме выше мы сначала получили реактив Гриньяра, а потом использовали его для синтеза. Однако можно записать получение реактива Гриньяра и сам синтез в одну реакцию, как показано на примерах ниже.
В результате электролиза солей карбоновых кислот может происходить образование алканов.
Химические свойства алканов
Реакции с хлором на свету происходят по свободнорадикальному механизму. На свету молекула хлора распадается на свободные радикалы, которые и осуществляют атаку на молекулу углеводорода.
Реакция Коновалова заключается в нитровании алифатических (а также ароматических) соединений разбавленной азотной кислотой. Реакция идет при повышенном давлении, по свободнорадикальному механизму.
Все органические вещества, в их числе алканы, сгорают с образованием углекислого газа и воды.
В ходе каталитического, управляемого окисления, возможна остановка на стадии спирта, альдегида, кислоты.
В реакциях, по итогам которых образуются изомеры, используется характерный катализатор AlCl3.
Вам уже известно, что в результате крекинга образуется один алкан и один алкен. Это не только способ получения алканов, но и их химическое свойство.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Пропан: способы получения и химические свойства
Пропан C3H8 – это предельный углеводород, содержащий три атома углерода в углеродной цепи. Бесцветный газ без вкуса и запаха, нерастворим в воде и не смешивается с ней.
Гомологический ряд пропана
Все алканы — вещества, схожие по физическим и химическим свойствам, и отличающиеся на одну или несколько групп –СН2– друг от друга. Такие вещества называются гомологами, а ряд веществ, являющихся гомологами, называют гомологическим рядом.
Продолжить гомологический ряд можно, последовательно добавляя группу –СН2– в углеводородную цепь алкана.
| Название алкана | Формула алкана |
| Метан | CH4 |
| Этан | C2H6 |
| Пропан | C3H8 |
| Бутан | C4H10 |
| Пентан | C5H12 |
| Гексан | C6H14 |
| Гептан | C7H16 |
| Октан | C8H18 |
| Нонан | C9H20 |
| Декан | C10H22 |
Общая формула гомологического ряда алканов CnH2n+2.
Первые четыре члена гомологического ряда алканов – газы, C5–C17 – жидкости, начиная с C18 – твердые вещества.
Строение пропана
В молекулах алканов встречаются химические связи C–H и С–С.
Связь C–H ковалентная слабополярная, связь С–С – ковалентная неполярная. Это одинарные σ-связи. Атомы углерода в алканах образуют по четыре σ-связи. Следовательно, гибридизация атомов углерода в молекулах алканов – sp 3 :
Поэтому четыре гибридные орбитали углерода в алканах направлены в пространстве под углом 109 о 28′ друг к другу:
Это соответствует тетраэдрическому строению.
| Например, в молекуле пропана C3H8 атомы водорода располагаются в пространстве в вершинах тетраэдров, центрами которых являются атомы углерода. При этом углеродный скелет образует угол, т.е. геометрия молекулы — уголковая или V-образная. |
Изомерия пропана
Для пропана не характерно наличие изомеров – ни структурных (изомерия углеродного скелета, положения заместителей), ни пространственных.
Химические свойства пропана
Пропан – предельный углеводород, поэтому он не может вступать в реакции присоединения.
Для пропана характерны реакции:
Разрыв слабо-полярных связей С – Н протекает только по гомолитическому механизму с образованием свободных радикалов.
Поэтому для пропана характерны радикальные реакции.
Пропан устойчив к действию сильных окислителей (KMnO4, K2Cr2O7 и др.), не реагирует с концентрированными кислотами, щелочами, бромной водой.
1. Реакции замещения
В молекулах алканов связи С–Н более доступны для атаки другими частицами, чем менее прочные связи С–С.
1.1. Галогенирование
Пропан реагирует с хлором и бромом на свету или при нагревании.
При хлорировании пропана образуется смесь хлорпроизводных.