С чем необходимо дифференцировать расширенные лимфатические сосуды молочной железы
Ультразвуковое исследование лимфатических узлов
УЗИ аппарат HM70A
Экспертный класс по доступной цене. Монокристальные датчики, полноэкранный режим отображения, эластография, 3D/4D в корпусе ноутбука. Гибкая трансформация в стационарный сканер при наличии тележки.
Оценка состояния зон регионарного лимфооттока при обследовании онкологических больных имеет решающее значение в определении лечебной тактики и прогнозе течения заболевания. Знание путей лимфооттока позволяет вести целенаправленный поиск метастатически измененных лимфатических узлов у больных со злокачественными новообразованиями. Уточнение локализации и количества выявленных измененных лимфатических узлов дает возможность уточнить стадию опухолевого процесса.
Выявление лимфатических узлов при физикальном осмотре не всегда возможно. Так, по данным R. Chandawarkar и S. Shinde [1], J. Verbanck и соавт. [2], чувствительность пальпации в выявлении лимфатических узлов колеблется от 50 до 88%. Глубоко залегающие лимфатические узлы, например, ретромаммарные, интрапекторальные и др., недоступны для клинической оценки при пальпации. Одним из ведущих методов обнаружения патологии лимфатических узлов является ультразвуковое исследование (УЗИ). Точность УЗИ в выявлении лимфатических узлов различна, она во многом зависит от локализации лимфатических узлов, качества аппаратуры, а также опыта исследователя. Специфичность УЗИ в выявлении и дифференциальной диагностике поражения лимфатических узлов составляет от 30 до 100% 6. Число работ, посвященных ультразвуковой диагностике метастатического поражения поверхностных лимфатических узлов, увеличивается [7, 8].
Периферические лимфатические узлы исследуют линейными датчиками с рабочей частотой 5-12 МГц, линейные и конвексные датчики с рабочей частотой 3-5 МГц можно использовать для осмотра больших периферических конгломератов.
Исследование регионарных чаще проводят на стороне поражения, иногда и на контралатеральной стороне, а при лимфогранулематозе, неходжкинских лимфомах, лейкозах и др. УЗИ необходимо проводить с учетом возможного поражения разных групп лимфатических узлов.
При проведении УЗИ следует определить локализацию лимфатических узлов, их число, форму, размер и структуру.
В норме лимфатические узлы представляют собой образования бобовидной, овальной или лентовидной формы и располагаются группами, чаще по несколько узлов.
Размеры лимфатических узлов зависят от возраста обследуемого, особенностей конституции и др. У клинически здоровых людей можно обнаружить лимфатические узлы, длина которых достигает 3,5 см. Существует разница в величине и форме лимфатических узлов разных регионарных групп и лимфатических узлов, расположенных в разных областях у одного и того же индивидуума.
Форма лимфатических узлов в значительной мере зависит от их топографоанатомических отношений с прилежащими органами, обычно она несколько продолговатая и сплюснутая, немного выпуклая с одной стороны и с небольшой впадиной с другой, напоминает фасоль. Иногда форма лимфатического узла может быть округлой. В пожилом и старческом возрасте нередко встречаются лентовидные формы лимфатических узлов, которые можно рассматривать как результат слияния более мелких узлов. На участках, ограниченных фасциями (например, в затылочной области), узлы более вытянуты в длину, чем те, которые располагаются в рыхлой клетчатке (например, подмышечные) (рис. 1, 2).
Эхогенность лимфатических узлов оценивают по отношению к окружающим тканям (чаще клетчатке) и описывают как высокую, среднюю и низкую (гипер- или гипоэхогенные, изо- или анэхогенные лимфатические узлы) (рис. 3, 4).
Рис. 3. Метастазы в лимфатические узлы (LN) шеи (Ln. Рretrachealis и Lnn. laterotracheales sinistri). Гипоэхогенные округлые гомогенные лимфатические узлы.
Рис. 4. Состояние после тиреоидэктомии. Изоэхогенный лимфатический узел претрахеальный (слева).
Паренхима лимфатического узла подразделяется на корковое вещество, расположенное ближе к капсуле, и медуллярную (мозговую) часть, занимающую центральные отделы узла, находящиеся ближе к воротам органа. Соотношение коркового и мозгового вещества варьирует в зависимости от локализации лимфатических узлов.
Структура лимфатических узлов изменяется в зависимости от этапности их расположения. Так, при оценке структуры лимфатических узлов шеи, расположенных рядом с органом, видно, что наиболее близко расположенные к органу лимфатические узлы (непостоянно присутствующие) имеют относительно небольшие размеры, округлую или веретенообразную форму, в них в меньшей степени выражено корковое вещество. В лимфатических узлах, расположенных дальше от органа, корковое вещество развито лучше.
Под взаимоотношением лимфатического узла с окружающими тканями понимается взаиморасположение узла и окружающих тканей: отсутствие связи или сохранение капсулы лимфатического узла и наличие прослойки клетчатки (или соединительной ткани) между лимфатическим узлом и другими структурами; соприкосновение или прилегание к органу (сосуду и др.) без нарушения его целости; вовлечение в опухолевый процесс.
У лиц пожилого возраста выявляют редукцию и склерозирование лимфатических узлов, некоторые из них срастаются между собой (у пожилых чаще определяются крупные лимфатические узлы). При этом наблюдается замещение больших участков узла жировой тканью. Жировая инфильтрация в старческом возрасте разрушает капсулу узла. Проросшие жиром лимфатические узлы (чаще периферические) выглядят как округлые и овальные структуры с гиперэхогенной гетерогенной (иногда сетчатой) центральной частью и относительно тонким гипоэхогенным ободком. Капсула узла может быть видна фрагментарно.
Локализация лимфатического узла описывается по отношению к анатомической области, сосудисто- нервному пучку либо к органу, рядом с которым находится выявленный лимфатический узел (в средней трети шеи, кнаружи от сосудисто-нервного пучка).
Для удобства диагностики банальные (неспецифические) лимфадениты дифференцируют следующим образом:
Рис. 6. Острый лимфаденит (лимфатический узел в средней трети шеи слева кнаружи от сосудистого пучка у больного с тромбозом яремной вены). Капсула четко не дифференцируется.
Реактивные изменения, возникающие в ответ на различные патологические процессы в организме (воспалительный процесс, проведение вакцинации и др.), способствуют увеличению лимфатического узла, напряжению его капсулы, усилению сосудистого рисунка, расширению корковой и околокорковой зон, отеку и разволокнению капсулы, расширению синусов, в лимфатическом узле могут встречаться единичные анэхогенные «кистозные » структуры, в дальнейшем может происходить абсцедирование. Следует учитывать, что изменения в лимфатических узлах, расположенных рядом с опухолью, могут выражаться в неспецифической реакции воспалительного характера (рис. 8).

а, б) Увеличение лимфатического узла, утолщение гипоэхогенной периферической части, утолщение капсулы (показано стрелкой).
По мнению M. Choi и соавт. [9], сосуды в воспаленном расширены в сравнении с сосудами метастатически измененного лимфатического узла, которые, напротив, могут быть сдавлены клетками опухоли.
В нормальных и реактивно измененных при воспалении лимфатических узлов видимые сосуды чаще расположены в области ворот лимфатических узлов или не определяются вовсе. В крупном гиперплазированном лимфатическом узле сосудистый рисунок в периферических отделах упорядочен, сосуды (артерии) определяются вдоль капсулы и радиально от ворот к периферии.
При гиперплазии в случае положительного эффекта лечения лимфатических узлов становятся менее контрастными, размеры их уменьшаются. При хроническом лимфадените часто отмечается утолщение капсулы, спаяние ее с окружающими тканями.
О метастатическом поражении при больших размерах узлов, их неправильной форме, неровных или нечетких контурах уверенно можно говорить при наличии анэхогенных участков в узлах, выявлении конгломератов лимфатических узлов (рис. 9, 10).
а) Метастаз в лимфатический узел.
б) Гиперплазированный лимфатический узел (сохраняется центральная гиперэхогенная структура).
Рис. 10. Сосудистый рисунок периферического гиперплазированного лимфатического узла (подострый лимфаденит).
При метастатическом поражении лимфатического узла происходит изменение его формы, размеров, эхогенности и структуры. Описанный феномен лежит в основе использования УЗИ для диагностики метастатического поражения лимфатических узлов.
P. Vassallo и соавт. (1993) показали, что опухолевая инфильтрация приводит к изменению формы лимфатического узла (отношение поперечного и продольного размеров или длинной и короткой осей лимфатического узла менее 1,5): он становится округлым, гипо- или анэхогенным, видно расширение кортикального слоя. Таким образом, чем ближе форма лимфатического узла к округлой, тем больше вероятность опухолевого поражения лимфатического узла. Капсула узла при инфильтрации и прорастании в окружающие ткани четко не определяется, контур становится размытым.
Известно, что при метастатическом поражении лимфатических узлов в них увеличивается содержание жидкости. При проведении УЗИ отмечают стирание рисунка лимфатического узла уже на начальном этапе (замещение клетками опухоли) 10. Капсула лимфатического узла дифференцируется, но при прорастании за пределы капсулы контур узла становится размытым. При инфильтрации капсулы, в дальнейшем (прорастании окружающих тканей) распространении за пределы лимфатического узла и срастании нескольких узлов отмечается образование конгломератов.
Таким образом, изображение структуры метастатически пораженных лимфатических узлов может быть: гипоэхогенной вплоть до анэхогенной, гиперэхогенной гетерогенной (полиморфной неоднородной) за счет чередования гипер- и гипоэхогенных участков и с наличием локальных гипоэхогенных участков на фоне неизмененной или гиперплазированной структуры лимфатических узлов.
При злокачественных процессах в лимфатических узлах наиболее часто отсутствует гиперэхогенная центральная часть или отмечается ее истончение, что соответствует диффузному или тотальному замещению центральных отделов опухолевой тканью. В некоторых случаях при метастатическом поражении только центральной части лимфатического узла он может выглядеть неизмененным, так как происходит имитация изображения ворот опухолевой тканью (чаще встречается при высокодифференцированном плоскоклеточном раке или других формах рака, которые сопровождаются коагуляционным некрозом, в случае ишемической дегенерации). Иногда можно наблюдать лимфатический узел в виде полностью гиперэхогенного образования. Хотя последнее более характерно для жировой инфильтрации, в этих случаях все же нельзя полностью исключать опухолевый генез изменений.
Структура лимфатического узла при замещении опухолевой тканью чаще гетерогенная или гипоэхогенная. Встречаются анэхогенные лимфатические узлы (например, при меланоме) или изо- и гиперэхогенные (при папиллярном раке). Иногда могут визуализироваться гиперэхогенные включения (кальцинаты) в метастатически измененном лимфатическом узле, может наблюдаться также внутриузловой некроз с характерной гетерогенной ультразвуковой картиной.
В метастатически измененных лимфатических узлах отмечается диффузное усиление васкуляризации с широким диапазоном скоростей и атипичным сосудистым рисунком (хаотично расположенные сосуды с наличием артериовенозных шунтов). По данным спектрального анализа, имеются низкие значения индекса резистентности при одновременной высокой диастолической составляющей.
Экстракапсулярный рост метастазов в лимфатических узлах часто приводит к объединению нескольких пораженных лимфатических узлах в бесформенный конгломерат и вовлечению в опухолевый процесс окружающих тканей. Признаком инфильтративного роста за пределы капсулы узла является нечеткость его контуров. Следует также определять вовлечение в опухолевый конгломерат прилежащих органов и структур, описывать характер этого вовлечения.
По данным T. Arita и соавт. (1993), УЗИ эффективно и при оценке изменений лимфатических узлов в динамике.
Оценивая состояние лимфатических узлов, следует помнить, что наличие измененного лимфатического узла может свидетельствовать как о гиперплазии узла, так и о метастатическом его поражении, однако при множественном опухолевом поражении метастазы могут принадлежать разным опухолям. Так, Н.И. Богданская (1978) описала случай одновременного поражения шейного лимфатического узла метастазами рака щитовидной железы и лимфосаркомы (рис. 11).

Рис. 11. ЛГМ. Кровоток в лимфатических узлах шеи.
Достаточно характерная ультразвуковая картина лимфатических узлов наблюдается при лимфогранулематозе. При этом в большинстве случаев видно несколько увеличенных лимфатических узлов (одна или несколько групп лимфатических узлов). Узел имеет овальную или округлую форму, четко видимую капсулу, гомогенную, чаще слабо гипоэхогенную структуру. Группа увеличенных лимфатических узлов («пачка») представлена четко отграниченными, не прорастающими капсулу и не сливающимися между собой лимфатические узлы (как при метастатическом поражении, в виде конгломерата) и может локализоваться в какой-либо одной области (например, надключично справа или слева) или в нескольких областях (увеличенные лимфатические узлы средостения, надключичные и в нижней трети шеи с одной или обеих сторон и др.).
Литература
УЗИ аппарат HM70A
Экспертный класс по доступной цене. Монокристальные датчики, полноэкранный режим отображения, эластография, 3D/4D в корпусе ноутбука. Гибкая трансформация в стационарный сканер при наличии тележки.
Особенности диагностики при подозрении на диффузную форму рака молочной железы
Авторы статьи: Сарибекян Э.К., Пак Д.Д., Митина Л.А., Казакевич В.И., Колесникова Е.В., Леонова Н.Ю. (Федеральное государственное бюджетное учреждение «Московский научно-исследовательский онкологический институт имени П.А. Герцена» Министерства здравоохранения и социального развития РФ)
Изучены результаты обследования 26 женщин с диффузными изменениями молочной железы без чётко определяемого объёмного образования, подозрительными на рак. Дифференциальный диагноз проведён между раком, выраженным фиброзом, фиброаденоматозом, маститами различной этиологии. Отмечены особенности и сложности диагностики методами эхографии, рентгеновской маммографии, компьютерной томографии и ядерно-магнитнорезонансной томографии, которые в этих случаях могут быть малоинформативными. Необходимо тщательное исследование регионарных лимфоузлов, наличие метастазов, в которых в сочетании с клиническими изменениями в молочной железе (МЖ), подтверждают диагноз диффузной формы РМЖ. Любые подозрительные участки подлежат трепанобиопсии для морфологического исследования образцов ткани.
Рак молочной железы (РМЖ) занимает первое место среди злокачественных опухолей у женщин в большинстве Европейских стран и в России. По типу роста и развития опухоли различают узловую и диффузную формы рака молочной железы. Диффузные формы в структуре рака молочной железы составляют около 15-17 %, характеризуются агрессивным течением, неблагоприятным прогнозом, определенной сложностью ранней диагностики и верификации процесса. Большую часть диффузных раков составляют отёчные формы РМЖ. При диффузном раке молочная железа уплотнена, как правило, имеется положительный симптом «лимонной корки», возможна гиперемия кожи, пальпируется уплотнение без чётких границ и без узла. Макроскопически на разрезе молочной железы видны плотные тяжи серовато-желтого цвета или инфильтрата, который занимает большую часть железы, а иногда и всю её целиком.
Речь идёт о лучевых методах диагностики: ультразвуковом исследовании (УЗИ), цифровой рентгеновской маммографии, компьютерной томографии (КТ), ядерно-магнитно- резонансном (ЯМР) исследовании, стереотаксической пункционной биопсии под рентген- или ультразвуковым контролем. Современная диагностическая аппаратура позволяет выявлять опухоль молочной железы диаметром 4 мм и меньше и производить прицельную биопсию для верификации опухоли под ультразвуковой или рентгеновской навигацией.
При этом у каждого метода имеются особенности и ограничения визуализации объёмных образований в зависимости от свойств ткани железы и характера онкопроцесса. Рентгеновская маммография информативнее у больных старше 40 лет, при преобладании у них в железах инволютивных процессов и жировой ткани. При выраженном железистом компоненте и мастопатийно гиперплазированной ткани, характерной для молодых женщин, снижаются возможности рентгеновской маммографии в связи с тем, что образования «теряются» в гиперпластическом массиве тканей, особенно при её высокой плотности. В данной ситуации информативнее становится ультразвуковая диагностика.
КТ (по сравнению с УЗИ и маммографией) позволяет точнее обнаруживать опухоли, расположенные в ретромаммарном пространстве и определять степень распространения опухоли на переднюю грудную стенку, что имеет значение при планировании объёма оперативного вмешательства и лечебной тактики. КТ отчётливо выявляет утолщения структурного рисунка МЖ, утолщение кожи при отёчных формах рака, увеличение размеров одной МЖ в сравнении с другой. Однако перестройку структуры окружающей опухоль ткани и гиперваскуляризацию МЖ точнее визуализируют с помощью маммографии. КТ уступает маммографии и в обнаружении доклинических форм рака, поэтому КТ не проводят для диагностики непальпируемого РМЖ. Метод магнитно-резонансной томографии (МРТ) имеет высокие показатели чувствительности – 100 % и специфичности – 90 %. МРТ выполняют на томографе с напряжённостью магнитного поля 1,0 Тл. Исследование проводят до и после внутривенного введения контрастного препарата. Больную укладывают на живот, молочные железы помещают в специальную маммографическую «катушку», где создают необходимую компрессию железы. Диагноз рака ставят при обнаружении узлового образования, рисунок которого интенсивно и диффузно усиливается в течение первых двух минут после введения контрастного препарата. Специфические МР-признаки воспалительной формы РМЖ отсутствуют.
Однако в отличие от лучевых методов диагностики выполнение биопсии под контролем МРТ технически сложнее и применяется в немногих учреждениях. К тому же, метод дорогостоящий и трудоёмкий.
Таким образом, при исследовании диффузных форм рака возможны затруднения в постановке диагноза, связанные с плохой визуализацией объёмных образований, что удлиняет пери- од обследования и задерживает начало необходимого лечения. Увеличение числа амбулаторных посещений пациента также способствует большим финансовым затратам медицинского учреждения.
Материалы и методы
Обследованы 26 пациенток, обратившихся в ФГБУ «МНИОИ им. П.А. Герцена» за период 2008-2011 гг. с жалобами на неприятные ощущения и «чувство напряжения» в МЖ, а также внешнее изменение одной из молочных желез. Возраст больных варьировал от 35 до 69 лет, средний возраст составил 52,4 года. Менструальная функция сохранена у 12 (46,1 %) пациенток, в состоянии менопаузы находились 14 (53,8 %). Всем больным выполнено УЗИ и цифровая маммография, части больных проведено дополнительное обследование МЖ методами КТ и МРТ. УЗИ выполнены на аппаратах GE Medical Systems LOGIQ 9. Цифровая рентгеновская маммография – на аппарате Senographe ESSENTIAL в стандартных укладках – прямой и косой проекциях; при необходимости – в боковых и тангенциальных проекциях.
Результаты
При осмотре у всех больных имелась типичная клиническая картина диффузной формы РМЖ: поражённая МЖ увеличена, имеются выбухания одного, реже нескольких отделов железы, более выраженная пигментация, усиленный венозный рисунок кожи. В 9 случаях отмечен положительный симптом лимонной корки, из них в 3 случаях – в сочетании с гиперемией кожи. Пальпаторно отмечали уплотнение консистенции, чаще неоднородное, узловые образования не определяли, в ряде случаев имела место болезненность. На первых этапах обследования всем больным проведены УЗИ и рентгеновская маммография. Объёмные образования в железах не выявлены. У половины больных (13 человек) обнаружены метастазы в подмышечные лимфоузлы, их верифицировали путём тонкоигольной биопсии под УЗИ-контролем, в связи с чем диагноз РМЖ не вызывал сомнений. Наличие рака МЖ у данных больных подтверждено также иммунофенотипированием метастазов, доказавшим органную принадлежность к МЖ, и/или последующим дообследованием (повторные УЗИ, КТ, трепанобиопсии подозрительных участков, гистологическое исследование операционного материала).
Ультразвуковая картина диффузной формы РМЖ В В-режиме ультразвуковая картина диффузной формы рака молочной железы чаще схожа с ультразвуковой картиной мастита или фиброза (рис. 1).
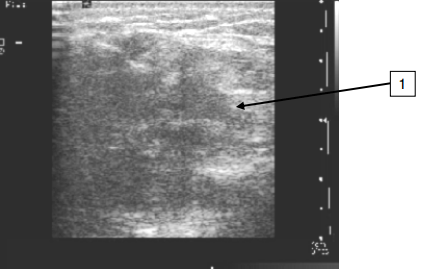
Рис. 1. Ультразвуковое исследование с применением линейного датчика. Структура ткани изменена, выявляется гипоэхогенный участок ткани (1) с выраженной гетерогенной структурой, имитирующий раковый узел с неровными нечёткими контурами. Кожа утолщена до 10-11 мм. Гистологическое исследование биоптата определило – фиброзная ткань.
У 9 пациенток выявлен отёк кожи. Толщина кожи колебалась от 5 до 8,2 мм. Глубже, на границе кожи и подкожной клетчатки у всех обследованных больных с большей или меньшей чёткостью выявляли гипоэхогенные трубчатые структуры от 1,2 до 2,6 мм. Данные изменения представляют расширенные лимфатические протоки и сосуды, которые, как правило, не визуализируются в нормальной ткани железы и при узловых формах рака. Как отёк, так и опухолевая инфильтрация приводят к повышению эхогенности ткани, жировая клетчатка выглядит более гиперэхогенной в пораженной железе по сравнению с жировой клетчаткой контрлатеральной (здоровой) молочной железы. Такая структура ткани приводит к выраженному затуханию эхо-сигнала. В толще паренхимы выявляли мелкие, до 2 мм, гиперэхогенные включения, дающие нечёткое затухание эхосигнала. Выявление и верификация опухолевого процесса в подобной ситуации могут представлять значительные трудности. При центральном допплеровском карти- ровании и допплерографии в расширенных сосудистых структурах определяется кровоток с венозным или артериальным типом, что свидетельствует о принадлежности трубчатых структур к сосудам. При раке количество сосудов крови относительно больше, чем при мастите, а при мастите больше расширенных лимфатических протоков. Причем, при раке сосуды могут визуализироваться не только как структуры, параллельные коже, но и как перпендикулярные или идущие под различными углами к коже. Более извитые сосуды могут визуализироваться и в более глубоких отделах измененной железы. Вся описанная ультразвуковая семиотика мало эффективна при проведении дифференциальной диагностики между диффузной формой рака и доброкачественными изменениями, приводящими к отёку железы. Объективным косвенным ультразвуковым критерием наличия РМЖ служит выявление метастазов в лимфоузлы подмышечной области, которые очень часто поражаются при диффузной форме рака.
Для подтверждения сложности различий дифференциальной диагностики диффузной формы РМЖ от фиброза приводим следующее наблюдение (пример, рис. 2).
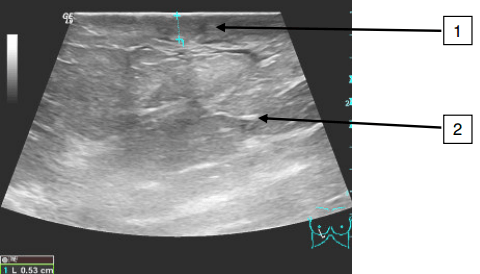
Рис. 2. Эхографическая картина отёчной молочной железы, полученная высокочастотным линейным датчиком (трапециевидная развертка). Утолщение кожи (1). Ткани железы отёчные, повышение эхогенности. В верхних отделах выявлены гипоэхогенные трубчатые структуры от 1,2 до 2,6 мм (2).
Выводы
Диагностирование диффузных изменений в МЖ без чётко определяемого объёмного образования является сложной задачей. Дифференциальный диагноз проводят между раком, выраженным фиброзом и фиброаденоматозом, маститами различной этиологии. Визуальную кар- тину изменения ткани железы, полученную с помощью эхографии, рентгеновской маммографии, компьютерной томографии и ядерно-магнитно-резонансной томографии можно интерпретировать по-разному. В связи с этим, вышеуказанные методы могут быть малоинформативны- ми. Необходимо тщательное исследование регионарных лимфоузлов, наличие метастазов в которых в сочетании с клиническими изменениями в МЖ, подтверждают диагноз диффузной формы РМЖ. Любые подозрительные участки подлежат биопсии. При клинической картине, подозрительной на диффузную форму РМЖ, необходимо добиваться точного диагноза в связи с тяжёлыми последствиями ошибки и несвоевременного диагностирования.