Cucl2 это что в химии
Меди хлорид
Химическое название
Химические свойства
Средство представляет собой бинарное неорганическое вещ-во, относится к классу солей и галогенидов. Его можно рассматривать как соль, образованную соляной кислотой и медью.
Рацемическая формула Хлорида Меди: CuCl2.
Молекулярная масса данного соединения = 134,5 грамм на моль. Вещество плавится при 498 градусах Цельсия. Средство образует кристаллогидраты вида CuCl2•nH2O.
В медицине используют дигидрат Меди Хлорида.
Средство в твердом виде – желто-коричневые кристаллы. Состав кристаллогидратов зависит от температуры, при которой происходит кристаллизация. Вещество хорошо растворимо в этиловом спирте, воде, ацетоне и метаноле.
Реакции Хлорида меди
Вещество вступает во взаимодействие со щелочью, при этом, как правило, образуется нерастворимое основание и растворимая соль. Меди Хлорид реагирует с металлами, которые в электрохимическом ряду располагаются левее металла Cu. Также соединению свойственны реакции ионного обмена с прочими солями, в результате образуется нерастворимое вещество и выделяется газ.
В промышленных масштабах средство получают реакцией Оксида меди 2 с соляной кислотой или путем обменной реакции Хлорида бария с Медным купоросом.
Также существует соединение Хлорид меди 1, в котором медь является одновалентной. Монохлорид этого металла – достаточно токсичное соединение.
Фармакологическое действие
Фармакодинамика и фармакокинетика
Медь – необходима организму. Например, она принимает участие в ряде химических реакций, протекающих в тканях печени. После попадания в организм вещество практически полностью метаболизируется.
Показания к применению
Раствор Хлорида Меди входит в состав растворов, используемых при парентеральном питании, и удовлетворяет потребность организма в микроэлементах.
Противопоказания
Препараты, в составе которых есть р-р нельзя использовать, если у пациента аллергия на вещества в составе, детям, не достигшим 10-летнего возраста. Осторожность следует соблюдать при почечной или печеночной недостаточности.
Побочные действия
Обычно лекарство хорошо переносится больными. Редко во время инфузии возникает тошнота и болезненные ощущения в месте введения.
Хлорид меди, инструкция по применению (Способ и дозировка)
Средство вводят внутривенно.
Если препарат изначально находится в виде порошка, его разводят в растворах глюкозы или аминокислот.
Полученный раствор необходимо использовать в течение суток.
Режим дозирования и схема лечения зависят от препарата и заболевания.
Передозировка
Передозировка препаратом возникает редко. Чаще всего его используют под наблюдением мед. персонала и в стационаре.
Если лекарственное средство вводят слишком быстро, то могут развиться: рвота, потливость, гиперемия кожных покровов. Реакции проходят после снижения скорости введения препарата.
Взаимодействие
Смешивать вещество в одном шприце или пакете можно только с р-ми глюкозы или аминокислот, концентрация которых не превышает 50%.
При беременности и лактации
Средство можно назначать беременным женщинам.
Существует недостаточное количество данных об использовании данного компонента в период кормления грудью.
Хлорид меди(II)
| Хлорид меди(II) | |||||||
 | |||||||
| Общие | |||||||
|---|---|---|---|---|---|---|---|
| Систематическое наименование | Хлорид меди(II) | ||||||
| Традиционные названия | Дихлорид меди | ||||||
| Химическая формула | CuCl2 | ||||||
| Эмпирическая формула | CuCl2 | ||||||
| Физические свойства | |||||||
| Состояние (ст. усл.) | твёрдое | ||||||
| Молярная масса | 134,452 г/моль | ||||||
| Плотность | 3,386 г/см³ | ||||||
| Термические свойства | |||||||
| Температура плавления | 498 °C | ||||||
| Температура кипения | 993 °C | ||||||
| Молярная теплоёмкость (ст. усл.) | 71,9 Дж/(моль·К) | ||||||
| Энтальпия образования (ст. усл.) | 215 [1] кДж/моль | ||||||
| Химические свойства | |||||||
| Растворимость в воде | 75,7 (25 °C) г/100 мл | ||||||
| Классификация | |||||||
| Рег. номер CAS | 7447-39-4 | ||||||
| RTECS | GL7000000 | ||||||
| Безопасность | |||||||
| Токсичность | CuCl 2 | ||||||
| Молярная масса | 134,45 г / моль (безводный) 170,48 г / моль (дигидрат) | ||||||
| Появление | желто-коричневое твердое вещество (безводное) сине-зеленое твердое вещество (дигидрат) | ||||||
| Запах | без запаха | ||||||
| Плотность | 3,386 г / см 3 (безводный) 2,51 г / см 3 (дигидрат) | ||||||
| Температура плавления | 498 ° C (928 ° F, 771 K) (безводный) 100 ° C (обезвоживание дигидрата) | ||||||
| Точка кипения | 993 ° С (1819 ° F, 1266 К) (безводный, разлагается) | ||||||
| 70,6 г / 100 мл (0 ° C) 75,7 г / 100 мл (25 ° C) 107,9 г / 100 мл (100 ° C) | |||||||
| Растворимость | метанол: 68 г / 100 мл (15 ° C) этанол: СОДЕРЖАНИЕСоставСвойства и реакцииГидролизГидроксид меди (II) выпадает в осадок при обработке растворов хлорида меди (II) основанием: CuCl 2 + 2 NaOH → Cu (OH) 2 + 2 NaCl Частичный гидролиз дает тригидроксид хлорида дигидрохлорида Cu 2 (OH) 3 Cl, популярный фунгицид. РедоксХлорид меди (II) (CuCl 2 ) реагирует с несколькими металлами с образованием металлической меди или хлорида меди (I) (CuCl) с окислением другого металла. Чтобы преобразовать хлорид меди (II) в хлорид меди (I), может быть удобно восстановить водный раствор диоксидом серы в качестве восстановителя: 2 CuCl 2 + SO 2 + 2 H 2 O → 2 CuCl + 2 HCl + H 2 SO 4 Координационные комплексыНекоторые из этих комплексов можно кристаллизовать из водного раствора, и они принимают широкий спектр структур. Однако «мягкие» лиганды, такие как фосфины (например, трифенилфосфин ), йодид и цианид, а также некоторые третичные амины, индуцируют восстановление с образованием комплексов меди (I). ПодготовкаХлорид меди (II) получают в промышленных масштабах путем хлорирования меди. Медь при красном нагреве (300-400 ° C) непосредственно соединяется с газообразным хлором, давая (расплавленный) хлорид меди (II). Реакция очень экзотермическая. Также коммерчески практично комбинировать оксид меди (II) с избытком хлорида аммония при аналогичных температурах, получая хлорид меди, аммиак и воду: Естественное явлениеХлорид меди (II) встречается в природе в виде очень редкого безводного минерала толбахита и дигидрата эриохальцита. Оба найдены возле фумарол и в некоторых медных рудниках. Чаще встречаются смешанные оксигидроксид-хлориды, такие как атакамит Cu 2 (OH) 3 Cl, образующиеся среди зон окисления Cu рудных пластов в засушливом климате (также известные из некоторых измененных шлаков). ИспользуетСокатализатор в процессе WackerКатализатор в производстве хлораХлорид меди (II) используется в цикле медь – хлор, в котором он расщепляет водяной пар на соединение кислорода меди и хлористый водород, а затем восстанавливается в цикле из электролиза хлорида меди (I). Другие области применения органических синтетических материаловТакие соединения являются промежуточными продуктами в синтезе BINAP и его производных. CuCl 2 также катализирует свободнорадикальное присоединение сульфонилхлоридов к алкенам ; затем альфа-хлорсульфон может быть отщеплен основанием с образованием винилсульфонового продукта. Ниша используетХлорид меди (II) также используется в пиротехнике как сине-зеленый краситель. При испытании пламенем хлориды меди, как и все соединения меди, излучают зелено-синий цвет. В картах индикаторов влажности (HIC) на рынке можно найти HIC от коричневого до лазурного цвета без кобальта (на основе хлорида меди (II)). В 1998 году Европейское сообщество (ЕС) классифицировало предметы, содержащие хлорид кобальта (II) от 0,01 до 1% по весу, как T (токсичные) с соответствующей R-фразой R49 (может вызвать рак при вдыхании). Как следствие, были разработаны новые не содержащие кобальта карты индикаторов влажности, содержащие медь. БезопасностьХлорид меди (II), характеристика, свойства и получение, химические реакцииХлорид меди (II), характеристика, свойства и получение, химические реакции.Хлорид меди (II) – неорганическое вещество, имеет химическую формулу CuCl2. Краткая характеристика хлорида меди (II):Хлорид меди (II) – неорганическое вещество жёлто-бурого (по некоторым данным – тёмно-коричневого) цвета. Химическая формула хлорида меди (II) CuCl2. Хлорид меди (II) – неорганическое химическое соединение, соль соляной кислоты и меди. Хорошо растворяется в воде, метаноле, этаноле, пропаноле, изопропаноле, ацетоне, бензиловом спирте, изоамиловом спирте. Плохо растворим в диэтиловом эфире. Растворяясь в воде, образует растворы различного цвета: – темно-коричневого цвета (концентрированный раствор CuCl2), С водой хлорид меди (II) образует кристаллогидраты с общей формулой CuCl2·nH2O, где n может быть 1, 2, 3 или 4: гидрат хлорида меди (II) CuCl2·H2O, дигидрат хлорида меди (II) CuCl2·2H2O, тригидрат хлорида меди (II) CuCl2·3H2O и тетрагидрат хлорида меди (II) CuCl2·4H2O. Образование кристаллогидратов зависит от температуры кристаллизации. При температуре ниже 117 °C образуется CuCl2·H2O, при ниже 42 °С – CuCl2·2H2O, при ниже 26 °С – CuCl2·3H2O, при ниже 15 °С – CuCl2·4H2O. Хлорид меди (II) является парамагнитным веществом. Хлорид меди (II) токсичен. В природе хлорид меди (II) встречается в виде минералов толбачита (CuCl2) и эрнохальцита (CuCl2·2H2O). При работе с медью двухлористой 2-водной (CuCl2·2H2O) следует применять индивидуальные средства защиты (респиратор, защитные очки, резиновые перчатки), а также соблюдать меры личной гигиены. Не допускать попадания препарата внутрь организма. Помещения, в которых производятся работы с медью двухлористой 2-водной, должны быть оборудованы эффективной приточно-вытяжной вентиляцией. Испытания препарата в лаборатории проводят в вытяжном шкафу (см. ГОСТ 4167-74 Реактивы. Медь двухлористая 2-водная. Технические условия). Медь двухлористая 2-водная ядовита, при попадании внутрь организма вызывает отравления, на кожу и слизистые оболочки – профессиональные заболевания кожи (см. ГОСТ 4167-74 Реактивы. Медь двухлористая 2-водная. Технические условия). Физические свойства хлорида меди (II):
хлористая медь (рус.) двухлористая медь (рус.) copper (II) chloride (англ.) | ||||||
| Тип вещества | неорганическое | ||||||
| Внешний вид | жёлто-бурые (тёмно-коричневые) моноклинные кристаллы | ||||||
| Цвет | жёлто-бурый (по некоторым данным – тёмно-коричневый) | ||||||
| Вкус | —* | ||||||
| Запах | — | ||||||
| Агрегатное состояние (при 20 °C и атмосферном давлении 1 атм.) | твердое вещество | ||||||
| Плотность (состояние вещества – твердое вещество, при 20 °C), кг/м 3 | 3 386 | ||||||
| Плотность (состояние вещества – твердое вещество, при 20 °C), г/см 3 | 3,386 | ||||||
| Температура кипения, °C | 993 | ||||||
| Температура плавления, °C | 498 | ||||||
| Молярная масса, г/моль | 134,452 | ||||||
| Гигроскопичность | гигроскопичен | ||||||
| Растворимость в воде (20 o С), г/100 г | 74,5 | ||||||
Получение хлорида меди (II):
В промышленности хлорид меди (II) получают хлорированием сульфида меди и с помощью хлорирующего обжига. В лабораторных условиях получают также и другими способами.
Хлорид меди (II) получают в результате следующих химических реакций:
1. взаимодействия сульфида меди и хлора (хлорирование сульфида меди):
CuS + Cl2 → CuCl2 + S (t = 300-400 °C).
Используется для получения хлорида меди (II) в промышленности.
2. взаимодействия сульфида меди, хлорида натрия и кислорода (хлорирующий обжиг):
Используется для получения хлорида меди (II) в промышленности.
3. взаимодействия металлической меди и хлора:
4. взаимодействия оксида меди и соляной кислоты.
5. взаимодействия гидроксида меди и соляной кислоты.
6. взаимодействия карбоната меди и соляной кислоты.
7. растворением меди в царской водке.
Химические свойства хлорида меди (II). Химические реакции хлорида меди (II):
1. реакция взаимодействия хлорида меди (II) и алюминия:
В результате реакции образуются медь и хлорид алюминия.
2. реакция взаимодействия хлорида меди (II) и цинка:
В результате реакции образуются медь и хлорид цинка.
3. реакция взаимодействия хлорида меди (II) и железа:
В результате реакции образуются медь и хлорид железа (II).
4. реакция взаимодействия хлорида меди (II) и меди:
В результате реакции образуется хлорид меди (I).
5. реакция взаимодействия хлорида меди (II) и палладия:
В результате реакции образуются хлорид палладия и хлорид меди (I).
6. реакция взаимодействия хлорида меди (II) и фтора:
В результате реакции образуются фторид меди (II) и хлор.
7. реакция взаимодействия хлорида меди (II) и гидроксида натрия :
CuCl2 + 2NaOH → CuO + H2O + 2NaCl (t°),
В результате реакции образуются в первом случае – хлорид натрия, оксид меди (II) и вода, во втором случае – гидроксид меди и хлорид натрия. В ходе реакций используется разбавленный раствор гидроксида натрия. Реакция в первом случае протекает при кипении. В ходе второй реакции образуется также примесь – гидроксид-хлорид меди (II).
8. реакция взаимодействия хлорида меди (II) и нитрата серебра:
В результате реакции образуются нитрат меди (II) и хлорид серебра.
9. реакция взаимодействия хлорида меди (II) и бромида бора:
В результате реакции образуются бромид меди (II) и хлорид бора.
10. реакция взаимодействия хлорида меди (II), сульфита натрия и гидроксида натрия:
В результате реакции образуются хлорид меди (I), сульфат натрия, хлорид натрия и вода. В ходе реакции используется разбавленный раствор гидроксида натрия.
11. реакция электролиза водного раствора хлорида меди (II):
12. реакция термического разложения дигидрата хлорида меди (II):
13. реакция термического разложения хлорида меди (II):
2CuCl2 → 2CuCl + Cl2 (t = 110-150 °C).
В результате реакции образуются хлорид меди (I) и хлор.
Применение и использование хлорида меди (II):
Хлорид меди (II) используется во множестве отраслей промышленности и для бытовых нужд:
– в цветной металлургии для омеднения металлов;
– в нефтехимической промышленности как катализатор крекинга, декарбоксилирования;
– в химической промышленности как катализатор для получения хлора;
– в органическом синтезе в качестве катализатора для синтеза органических соединений, в т.ч. в Ватер-процессе (процесс получения ацетальдегида прямым окислением этилена );
Примечание: © Фото https://www.pexels.com, https://pixabay.com
хлорид меди реагирует кислота 1 2 3 4 5 вода
уравнение реакций соединения масса взаимодействие хлорида меди
реакции
Хлорид меди (I)
| Хлорид меди (I) | |
|---|---|
 | |
 | |
| Систематическое наименование | Хлорид меди (I) |
| Традиционные названия | Хлористая медь |
| Хим. формула | CuCl |
| Состояние | твёрдое |
| Молярная масса | 98,999 г/моль |
| Плотность | 4,145 г/см³ |
| Температура | |
| • плавления | 426 °C |
| • кипения | 1490 °C |
| Энтальпия | |
| • образования | -136 кДж/моль |
| Растворимость | |
| • в воде | 0,0062 г/100 мл |
| Показатель преломления | 1,930 |
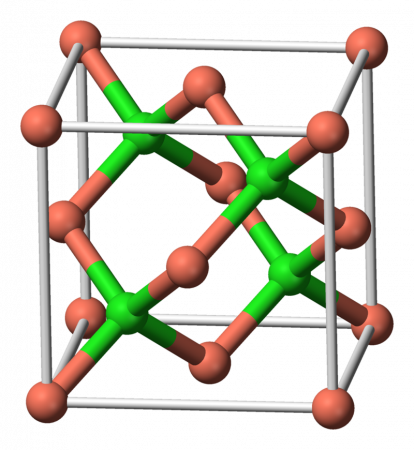
| Кристаллическая структура | Структура цинковой обманки |
| Рег. номер CAS | 7758-89-6 |
| PubChem | 62652 |
| Рег. номер EINECS | 231-842-9 |
| SMILES | |
| RTECS | GL6990000 |
| ChEBI | 53472 |
| Номер ООН | 2802 |
| ChemSpider | 56403 |
| ЛД50 | 140 мг/кг |
| Пиктограммы СГС |    |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Хлорид меди (I) — бинарное химическое соединение, медная соль хлороводородной кислоты.
Представляет собой белый или зеленоватый порошок, практически нерастворимый в воде (0,0062 г/100 мл при 20 °C). Зеленоватую окраску придают примеси хлорида меди (II).
Содержание
История открытия
Впервые хлорид меди (I) был получен Робертом Бойлем в 1666 году, из хлорида ртути (II) и металлической меди:
HgCl2 + 2Cu ⟶ 2CuCl + Hg
В 1799 году, Джозеф Луи Пруст успешно отделил дихлорид меди от монохлорида и описал эти соединения. Это было достигнуто путём нагревания CuCl2 в бескислородной среде, в результате чего хлорид меди(II) потерял половину связанного хлора. После этого он удалил остатки дихлорида меди от хлорида меди (I) и промыл водой.
Физические свойства
Монохлорид меди плавится и кипит без разложения. В пара́х молекулы полностью ассоциированы (димеры с незначительной примесью тримеров), поэтому формулу вещества иногда записывают как Cu2Cl2.
Плохо растворим в воде (0,062% при 20 °C), но хорошо в растворах хлоридов щелочных металлов и соляной кислоте. Так в насыщенном растворе NaCl растворимость CuCl составляет 8% при 40 °C и 15% при 90 °C. Водный раствор аммиака растворяет CuCl с образованием бесцветного комплексного соединения [Cu(NH3)2]Cl.
Получение
В природе монохлорид меди встречается в виде редкого минерала нантокит (по названию села Нантоко, Чили), который благодаря подмеси атакамита часто окрашен в зелёный цвет.
В промышленности монохлорид меди получают несколькими способами:
В лабораторной практике последний метод также широко распространён.
Химические свойства
Применение
Физиологическое действие
Хлорид меди (I) ядовит. Может привести к тяжёлым отравлениям. Относится ко 2-му классу опасности.
















