Торможение процессов пролиферации эндометрия что это значит
Что такое гиперплазия эндометрия? Причины возникновения, диагностику и методы лечения разберем в статье доктора Анькина А. О., врача УЗИ со стажем в 9 лет.
Определение болезни. Причины заболевания
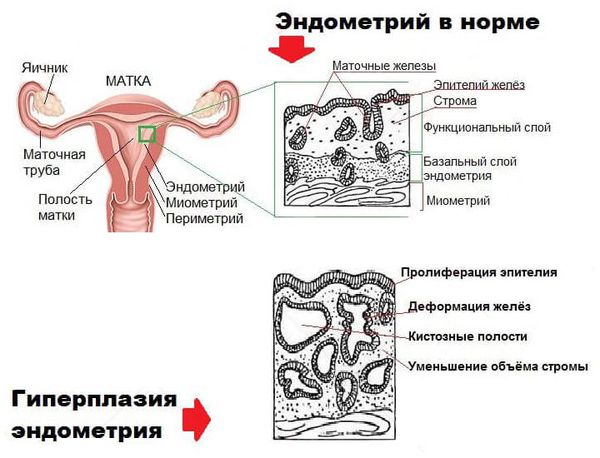
Диагноз « гиперплазия эндометрия » ставится только по заключению гистологического исследования. Без своевременной диагностики и целенаправленного лечения повышается риск развития рака эндометрия.
В составе маточного эндометрия есть специфические рецепторы, которые делают его органом-мишенью для половых гормонов. При гормональном сбое нарушается рост и дифференцировка эндометриальных клеток, что приводит к разрастанию эндометрия.
Факторы риска развития гиперплазии эндометрия [1] [8] [11] :
Симптомы гиперплазии эндометрия
В период перехода к менопаузе основным симптомом заболевания являются нерегулярные обильные менструации, сменяющиеся длительными мажущими кровянистыми выделениями.
Женщины менопаузального возраста жалуются на скудные кровянистые выделения из половых путей. Они могут проявляться эпизодически либо быть продолжительными.
Патогенез гиперплазии эндометрия
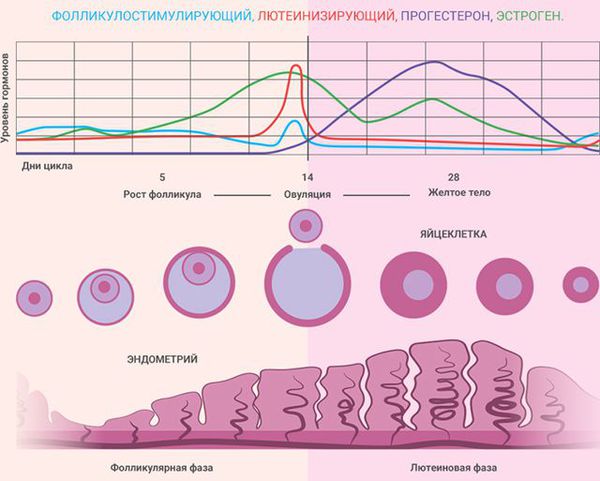
Состояние эндометрия зависит от фазы менструального цикла:
В патогенезе гиперплазии эндометрия выделяют два варианта развития событий:
В случае гиперплазии эндометрия с атипией избыток желёз эндометрия сочетается с клеточными мутациями (атипическим перерождением). Атипическая гиперплазия эндометрия является предраковым состоянием.
Классификация и стадии развития гиперплазии эндометрия
Международная классификация болезней 10-го пересмотра (МКБ-10):
Пересмотренная классификация ВОЗ 2014 года:
Осложнения гиперплазии эндометрия
Анемия. Для гиперплазии эндометрия характерны аномальные маточные кровотечения. В связи с этим женщины часто страдают от хронического малокровия разной степени выраженности.
Бесплодие. Гормональные изменения отражаются на качестве эндометрия, что создаёт риск неудачной имплантации эмбриона. Помимо этого, гиперплазия эндометрия часто выявляется на фоне хронической ановуляции, при которой зачатие невозможно.
Диагностика гиперплазии эндометрия
Диагностика основана на анализе данных анамнеза пациентки (истории болезни), клинической картины заболевания (жалоб и физикального осмотра), а также на результатах ультразвукового и гистероскопического исследования с обязательным патоморфологическим анализом соскоба из полости матки.
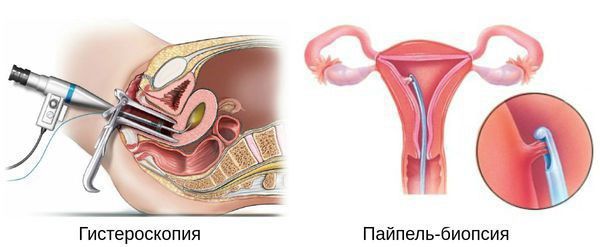
Диагноз «гиперплазия эндометрия» ставится только на основании гистологического исследования материала, полученного при диагностическом выскабливании слизистой оболочки матки или удалении матки.
Анамнез и клиническая картина
При сборе анамнеза врач-гинеколог задаёт пациентке вопросы:
Физикальный осмотр включает в себя местный осмотр наружных половых органов, исследование влагалища и шейки матки в зеркалах, а также бимануальное (двумя руками) исследование матки и придатков. Осмотр проводится на первичном приёме, чтобы исключить воспалительные заболевания и/или объёмные опухолевые образования.
Инструментальная диагностика
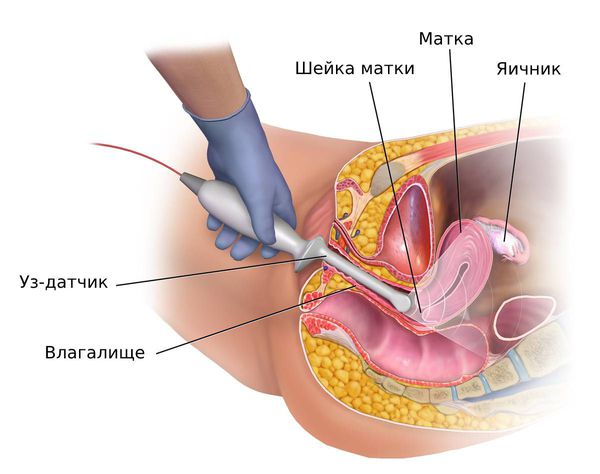
У женщин репродуктивного и пременопаузального возрастов при подозрении на гиперплазию эндометрия ТВУЗИ органов малого таза проводится на 5 – 7-й день менструального цикла. В норме в это время толщина эндометрия не превышает 6 мм. Патологию эндометрия подозревают, когда его толщина не соответствует определённой фазе менструального цикла:
Гистероскопия с раздельным диагностическим выскабливанием (РДВ) матки и цервикального канала — информативный метод в диагностике гиперпластических процессов эндометрия. При помощи гистероскопа (эндоскопического прибора для осмотра полости матки) врач оценивает состояние слизистой оболочки матки и цервикального канала. При необходимости удаляет локальные поражения и обязательно берёт материал для последующего гистологического исследования.
Если выскабливание проводят как лечебную процедуру при обильном маточном кровотечении, врач полностью удаляет слизистую оболочку матки под контролем гистероскопии.
Дифференциальная диагностика гиперплазии эндометрия проводится с полипом эндометрия, субмукозной (подслизистой) миомой матки, эндометритом, прервавшейся беременностью и раком эндометрия.
Лечение гиперплазии эндометрия
Лечение патологии эндометрия основывается на трёх принципах:
Тактика лечения будет зависеть от результата гистологического исследования эндометрия, полученного в ходе выскабливания, от возраста женщины, сопутствующих заболеваний и репродуктивных планов.
Гиперплазия эндометрия без атипии:
Гиперплазия эндометрия с атипией:
Медикаментозное лечение гормональными препаратами проводится пациенткам репродуктивного возраста с неатипической гиперплазией эндометрия при наличии симптомов, факторов риска, отсутствии регресса за 6 месяцев наблюдения и при атипической гиперплазии эндометрия у женщин, планирующих беременность.
Гормональную терапию назначают не менее чем на 6 месяцев:
В качестве негормональной терапии возможно применение препаратов:
Лечение нужно сочетать с низкокалорийной диетой и достаточной физической нагрузкой согласно общему физическому развитию женщины. При необходимости врач назначает препараты, которые нормализуют метаболизм углеводов в организме: подавляют образование глюкозы клетками печени, повышают чувствительность тканей к инсулину, расщепляют сложные сахара.
Хирургическое лечение. Атипическая гиперплазия эндометрия на начальном этапе требует обязательной консультации онкогинеколога, который должен установить, нужна ли операция и в каком объёме.
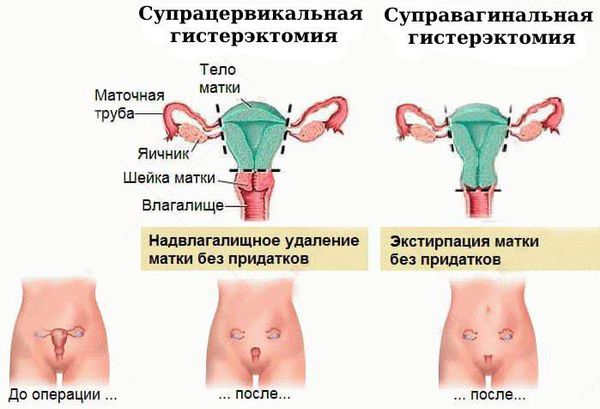
Чаще всего выполняется надвлагалищная ампутация матки — суправагинальная гистерэктомия (удаление тела и шейки матки). Вопрос о сохранении яичников решается строго индивидуально, зависит от возраста пациентки и факторов риска.
Показания к гистерэктомии:
Прогноз. Профилактика
Обследование для исключения гиперплазии или рака эндометрия показано в следующих случаях:
1. Если есть аномальные маточные кровотечения [29] [31] :
2. Если по результатам цитологического исследования соскоба шейки матки отмечается:
Профилактика:
Торможение процессов пролиферации эндометрия что это значит
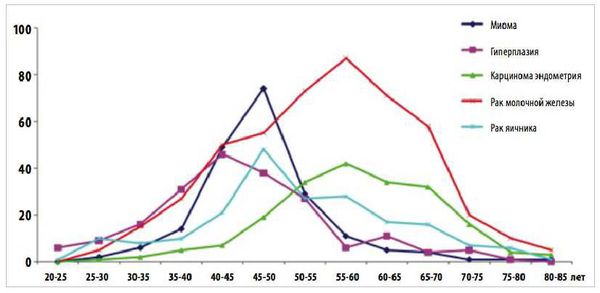
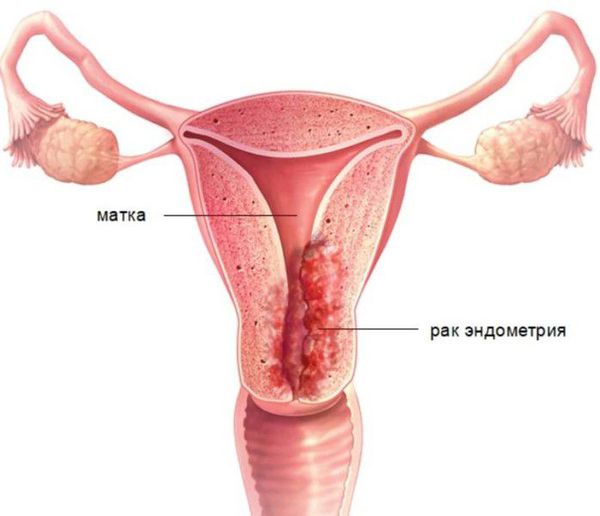
Пролиферативные процессы в эндометрии (ППЭ): полипы, железистая и атипическая гиперплазия в структуре внутриматочной патологии у пациенток в пре- и постменопаузе занимают лидирующее место (60-70%) [1, 2], имеют тенденцию роста в постменопаузальном периоде 7, часто рецидивируют (0,25-50%) [6, 8] и могут подвергнуться малигнизации. В свою очередь рак эндометрия находится на первом месте в структуре злокачественных гинекологических заболеваний [9], в структуре онкопатологии он расположен после рака молочной железы, прямой кишки и легких [10], наибольшая заболеваемость приходится на возрастной период 60-64 года [11].
Как в нашей стране, так и за рубежом имеется большое число работ, посвященных диагностике и лечению ППЭ. Однако проблема остается актуальной и нерешенной. В последние годы значительная часть работ посвящена изучению рецепторного аппарата половых стероидных гормонов в ткани эндометрия. Сведения о содержании рецепторов эстрадиола (ER) и прогестерона (PR) зачастую противоречивы. Ряд исследователей выявили связь между видом ППЭ и представленностью стероидных рецепторов в ткани. В частности, авторами отмечены повышение уровня рецепторов эстрадиола и отношения ER/PR в ткани эндометрия при железистой гиперплазии и максимальная концентрация обоих рецепторов при атипической гиперплазии [12, 13]. По данным других авторов, максимальная степень пролиферативной активности была определена в ткани при железистой гиперплазии и снижена при атипической гиперплазии и аденокарциноме эндометрия 15. В других работах [20, 21] не найдено зависимости концентрации стероидных рецепторов от типа патологического процесса в ткани эндометрия или же получены прямо противоположные результаты. Одной из возможных причин противоречивости представленных результатов, по-видимому, является то, что большинство авторов не учитывали возрастной период жизни пациенток, который в силу особенностей гормонального фона имеет большое значение в регуляции рецепторного профиля зависимых тканей [4, 5, 8]. Поэтому сравнительный анализ рецепторного состава ткани эндометрия с учетом возрастного периода пациентки является актуальным при разных видах ППЭ.
Отсутствие в литературе сведений об экспрессии генов отдельных подтипов рецепторов стероидных гормонов, а также белка р53 в ткани эндометрия при патологической пролиферации у пациенток в пре- и постменопаузе определило необходимость проведения данной работы.
Материал и методы
На кафедре акушерства и гинекологии педиатрического факультета ГБОУ ВПО «Российский национальный исследовательский университет им. Н.И. Пирогова» на базе 31-й городской клинической больницы Москвы за период с 2011 по 2014 г. обследованы 108 пациенток, находящихся в периоде пре- и постменопаузы, с пролиферативными процессами в эндометрии в возрасте от 47 до 92 лет.
Перед включением пациенток в исследование у каждой получено информированное согласие на участие. Исследование одобрено этическим комитетом ГБОУ ВПО РНИМУ им. Н.И. Пирогова.
Критериями исключения из исследования были прием гормональных препаратов (эстроген-гестагены, гестагены, агонисты гонадотропин-рилизинг-гормона, заместительная гормональная терапия, тамоксифен) в течение 3 мес перед обследованием, а также сопутствующие гинекологические заболевания: миома матки, размеры которой на момент исследования превышали 6-7 нед беременности, опухоли яичников.

Ведущей жалобой у ¾ пациенток в основной группе были маточные кровотечения. 14 из 56 пациенток в пре- и постменопаузе не предъявляли жалоб, патология эндометрия у них была диагностирована по данным УЗИ органов малого таза.
В основной группе у 22 из 56 пациенток в анамнезе были гистероскопия, раздельное диагностическое выскабливание слизистой оболочки матки, из них у 10 неоднократно (от 2 до 5 раз), при этом диагностированы гиперпластические процессы в эндометрии: 7 пациенток ранее по поводу ППЭ получали различные гормональные препараты.
Перед операцией у больных проводили забор венозной крови для определения в плазме уровня следующих гормонов: ЛГ, ФСГ, пролактина, прогестерона, эстрадиола, тестостерона с целью выявления их влияния на рецепторный профиль измененной ткани эндометрия.
Сравнительный анализ экспрессии гена р53 у пациенток разных возрастных групп выявил снижение уровня мРНК данного белка в ткани больных постменопаузального периода с атипической гиперплазией эндометрия в 2 раза по сравнению с той же патологией у пациенток в пременопаузе (5,81±1,77 и 11,32±8,30 отн. ед. соответственно; р=0,0001), что логично соотносится с более тяжелым прогнозом течения этого типа патологии у пациенток в постменопаузе.
Анализ гормонального профиля пациенток (табл. 2) показал, что уровни гонадотропинов, прогестерона и тестостерона в крови не зависели от вида пролиферативного процесса и находились в пределах референсных значений соответствующих возрастных групп. Уровень пролактина в плазме крови у пациенток в пременопаузе превышал максимально допустимые значения у 43% больных с железистой гиперплазией эндометрия и у 50% больных с атипической гиперплазией эндометрия. В постменопаузе превышение нормальных значений концентрации пролактина более чем в 2,5 раза (по сравнению с максимально возможным) отмечено у 80% пациенток с атипической гиперплазией эндометрия. Значение повышенного уровня пролактина в развитии гиперпластических процессов тканей матки отмечено в нескольких исследованиях [25].
Уровень эстрадиола в крови у включенных в исследование пациенток в пременопаузальном периоде находился в пределах референсных значений. В постменопаузе у большинства больных этот параметр превышал максимальные результаты: при ЖФПЭ у 84% пациенток, при атипической гиперплазии эндометрия у 80%, при высоко- и умереннодифференцированной аденокарциноме эндометрия у 50 и 44% пациенток соответственно. Прогредиентное снижение доли пациенток с повышенным уровнем эстрадиола параллельно со снижением степени дифференцировки ткани может отражать общую тенденцию ускользания зависимости пролиферации клеток из-под гормонального контроля.
Обсуждение
Установленное повышение экспрессии гена ERβ в ткани железистой гиперплазии эндометрия у пациенток в пременопаузе и в ткани атипической гиперплазии эндометрия у больных в постменопаузе по сравнению с экспрессией этого гормона в ткани ЖФПЭ аналогично полученным нами ранее результатам исследования экспрессии генов рецепторов эстрадиола и прогестерона в ткани полипов эндометрия [26], показавшим повышение экспрессии гена ERβ в ткани железистых полипов у пациенток в пременопаузе и в ткани аденоматозных полипов эндометрия у больных в постменопаузе. Функцию данного рецептора многие авторы связывают с антипролиферативным эффектом стероида. В связи с чем данное наблюдение, возможно, отражает один из компенсаторных механизмов уравновешивания пролиферативного дисбаланса в ткани.
В литературе встречаются отдельные указания относительно экспрессии гена рецептора ERβ при различных пролиферативных процессах эндометрия. Так, K. Hu и соавт. [15] с помощью иммуногистохимического исследования обнаружили существенное снижение экспрессии гена ERβ в ткани атипической гиперплазии и аденокарциномы эндометрия по сравнению с нормальным эндометрием, в то время как при простой и комплексной гиперплазии достоверных изменений авторами не выявлено. По всей видимости, в исследование были включены пациентки преимущественно постменопаузе, так как и в нашем исследовании у больных этой возрастной группы с умереннодифференцированной аденокарциномой эндометрия выявлено снижение уровня мРНК ERβ.
Анализ результатов исследования прогестероновых рецепторов показал повышение экспрессии генов мембранных рецепторов mPR и PGRmC1 у больных в пременопаузе в ткани железистой гиперплазии эндометрия и у пациенток в постменопаузе в ткани атипической гиперплазии эндометрия по сравнению с таковой в ткани ЖФПЭ. В свою очередь в ранее проведенном нами исследовании [26, 27] экспрессии генов рецепторов прогестерона в ткани железистых полипов эндометрия у женщин в пременопаузе выявлено увеличение уровня мРНК mPR и PGRmC1 по сравнению с аналогичными параметрами у больных с ЖФПЭ. Схожий характер изменения экспрессии генов мембранных рецепторов прогестерона при железистой гиперплазии и железистых полипах эндометрия позволяют нам предположить схожесть процессов патогенеза данных видов патологии у пациенток в пременопаузе.
Мембранные рецепторы прогестерона играют важную роль в контроле функции тканей репродуктивной системы [28]. В частности, mPR ингибирует апоптоз клеток-мишеней [29], что при повышении его экспрессии может приводить к накоплению мутаций и избыточной пролиферации клеток. Кроме того, стимуляция mPR приводит к трансактивации рецептора PR-B, который ингибирует активность PR-A [30]. Прогестерон через рецептор PGRmC1 ингибирует экспрессию генов проапоптотических белков [31], в связи с чем повышение синтеза данного рецептора может способствовать избыточному клеточному росту и накоплению мутаций.
Кроме того, выявлено повышение уровня мРНК ядерного рецептора PR-A у больных в пременопаузе в ткани железистой гиперплазии эндометрия и у пациенток в постменопаузе в ткани атипической гиперплазии эндометрия по сравнению с этим показателем в ткани ЖФПЭ. Экспрессия гена PR—A стимулируется эстрадиолом, концентрация которого была повышена у 80% пациенток в данной группе. В свою очередь прогестерон через рецептор типа PR-A оказывает отрицательное влияние на синтез ядерных рецепторов ERα, уровень которых, возможно, именно за счет этого не превышает показатели в ЖФПЭ.
Следовательно, наибольшие отличия экспрессии генов стероидных рецепторов выявлены в ткани железистой гиперплазии эндометрия у больных в пременопаузе и в ткани атипической гиперплазии эндометрия у больных в постменопаузе по сравнению с таковой в ткани ЖФПЭ. Данные изменения, вероятно, отражают компенсаторные механизмы, развивающиеся в ответ на происходящую патологическую пролиферацию, и перекликаются с результатами ряда исследований [12, 13]. Схожие изменения в рецепторном профиле данных процессов могут позволить представить экспрессию генов рецепторов ERβ, mPR, PGRmC1, а также PR-A в качестве маркера патологической пролиферации. Однако в ткани умереннодифференцированной аденокарциномы эндометрия у пациенток в постменопаузе отмечено снижение экспрессии генов всех стероидных рецепторов, скорее всего, свидетельствующее о функциональном истощении эндометрия на фоне его морфологической дедифференцировки, что не противоречит данным литературы 19.
Выявленное нами снижение выработки р53 при атипической гиперплазии эндометрия у пациенток в постменопаузе по сравнению с той же патологией у пациенток в пременопаузе, а также при умереннодифференцированной аденокарциноме эндометрия по сравнению с таковой в ткани ЖФПЭ у больных постменопаузального периода, вероятно, свидетельствует об истощении компенсаторных резервов ткани у пациенток этих групп. В литературе имеются данные об увеличении количества р53 в железах эндометрия у пациенток постменопаузального периода, которое авторы связывают с торможением апоптоза и относят к отрицательным прогностическим признакам [32]. Однако мы склонны считать, что в данном случае увеличение экспрессии р53 является вторичным, направленным на выполнение основной его функции, заключающейся в репарации поврежденной ДНК.
Выводы
Полученные данные могут свидетельствовать о существовании рецепторно-гомеостатической стабильности эндометрия, которая является максимальной в неизмененной ткани и нарушается при патологическом процессе. Степень тяжести нарушений стероидно-рецепторного профиля эндометрия при различных пролиферативных процессах прямо пропорциональна степени дифференцировки клеток, а также зависит от возрастного периода женщины и ее гормонального статуса. Выявленные вариации рецепторно-гомеостатической стабильности эндометрия могут служить причиной и объяснением особенностей пролиферативных процессов в эндометрии у пациенток в разных возрастных периодах и иметь значение при выборе метода их лечения, став основой персонализированного назначения гормональной терапии в послеоперационном периоде.
Работа выполнена в рамках НПР-2 «Персонализованная медицина» и ГЗ «Разработка новых молекулярных подходов для диагностики, профилактики и лечения пролиферативных процессов эндометрия и яичников» ГБОУ ВПО РНИМУ им. Н.И. Пирогова Минздрава России.
Гистологическое исследование эндометрия
Содержание
На сегодняшний день одним из самых распространенных тестов в области функциональной диагностики выступает гистологическое исследование соскоба эндометрия. Для проведения функциональной диагностики зачастую используется так называемый «штриховой соскоб», который подразумевает забор при помощи маленькой кюретки небольшой полоски эндометрия. Весь женский менструальный цикл подразделяется при этом на три фазы: пролиферация, секреция, кровотечения. Кроме того, фазы пролиферации и секреции подразделяют на раннюю, среднюю, а также позднюю; а фазу кровотечения — на десквамацию, а также регенерацию. Исходя из данного исследования, можно говорить о том, что эндометрий соответствует фазе пролиферации или какой-то другой фазе.
При оценивании изменений, которые происходят в эндометрии, следует учитывать длительность цикла, его основные клинические проявления (отсутствие или наличие послеменструальных или предменструальных отделений крови, продолжительность менструального кровотечения, объем кровопотери и прочее).
Женский менструальный цикл по фазам
Фаза пролиферации
Эндометрий ранней стадии фазы пролиферации (пятый-седьмой день) имеет вид прямых трубочек с небольшим просветом, на его поперечном срезе контуры желез являются круглыми или овальными; эпителий желез низкий, призматический, ядра имеют овальную форму, располагаются у основания клеток, окрашены интенсивно; поверхность слизистой выстилает кубический эпителий. Строма включает в себя веретенообразные клетки с крупными ядрами. А вот спиральные артерии извиты слабо.
В средней стадии (восьмой-десятый день) поверхность слизистой выстилает высокий призматический эпителий. Железы немного извитые. В ядрах выделяется множество митоз. На апикальном крае определенных клеток может выявиться кайма слизи. Строма является отечной, разрыхлённой.
В поздней стадии (одиннадцатый-четырнадцатый день) железы получают извилистое очертание. Просвет их уже расширен, ядра расположены на различном уровне. В базальном отделе некоторых клеток начинают выявляться мелкие вакуоли, которые содержат гликоген. Строма является сочной, увеличиваются ее ядра, окрашиваются и округляются с меньшей интенсивностью. Сосуды становятся извитой формы.
Описанные изменения являются характерными для нормального менструального цикла, могут отмечаться при патологии
Когда в функциональном слое эндометрия, соответствующего фазе пролиферации выявляются клубки спиральных сосудов, тогда это говорит о том, что предыдущий менструальный цикл был двухфазным, а в ходе очередных месячных не произошел процесс отторжения всего функционального слоя, он только подвергся обратному развитию.
Фаза секреции
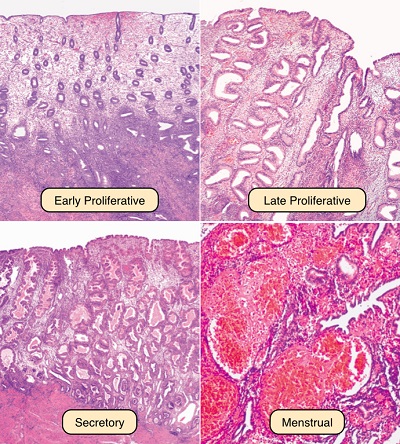
В течение средней стадии фазы секреции (девятнадцатый – двадцать третий день) расширены просветы желез, у них складчатые стенки. Эпителиальные клетки являются низкими, наполнены секретом, который отделяется в просвет железы. В строме во время двадцать первого-двадцать второго дня начинает появляться децидуаподобная реакция. Спиральные артерии являются резко извитыми, образовывают клубки, что выступает одним из самых достоверных признаков абсолютно полноценной лютеиновой фазы. Такая структура эндометрия может отмечаться:
В период поздней стадии фазы секреции (двадцать четвертый – двадцать седьмой день) из-за регресса желтого тела сводится к минимуму сочность ткани; уменьшается высота функционального слоя. Нарастает складчатость желез, получая пилообразную форму. В просвете желез находится секрет. У стромы интенсивно выражена периваскулярная децидуаподобная реакция. Спиральными сосудами образуются клубки, которые тесно прилегают друг к другу. На двадцать шестой-двадцать седьмой дни венозные сосуды заполнены кровью с появлением тромбов. Инфильтрация лейкоцитами появления в строме компактного слоя; возникают и нарастают очаговые кровоизлияния, а также участки отека. Такое состояние нужно дифференцировать с эндометритом, когда клеточный инфильтрат находится преимущественно вокруг желез и сосудов.
Фаза кровотечения
Ненормальное состояние эндометрия характеризуют так называемые гиперпластические пролиферативные изменения (железисто-кистозная гиперплазия, железистая гиперплазия, аденоматоз, смешанная форма гиперплазии), а также гипопластическими состояниями (нефункционирующий, покоящийся эндометрий, переходный эндометрий, гипопластический, диспластический, смешанный эндометрий).
Самые важные и интересные новости о лечении бесплодия и ЭКО теперь и в нашем Telegram-канале @probirka_forum Присоединяйтесь!