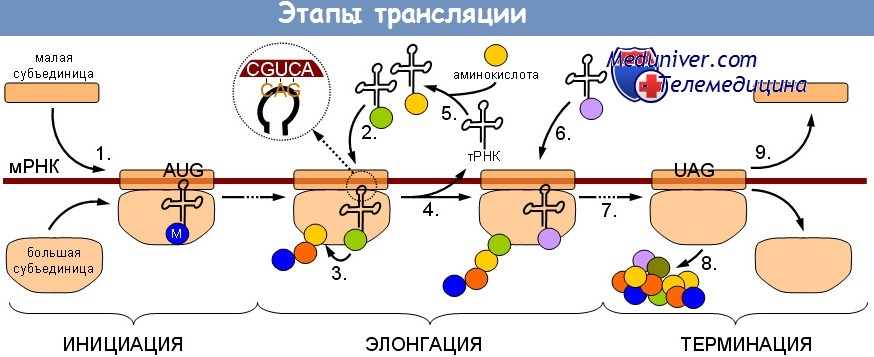
Синтез белков регулируется чем
Синтез белков регулируется чем
В самом общем понимании термин «синтез белка» означает несколько процессов, необходимых для преобразования гена в функциональный белок. Каждый процесс состоит из нескольких этапов, а регулирование может происходить на одном или нескольких этапах в рамках каждого процесса.
За последние 30 лет были достигнуты определенные успехи в понимании регуляции синтеза белка на молекулярном уровне, и теперь благодаря сведениям о полной последовательности генома у все большего числа различных организмов, в том числе грызунов и человека, новая информация, проясняющая и расширяющая наше понимание регуляции синтеза белка, накапливается быстрее, чем когда бы то ни было в прежние времена.
Обнаружение того, что геном человека содержит около 35 000 генов — примерно в 2 раза больше, чем было выявлено у беспозвоночных, — заставило научное сообщество пересмотреть влияние генома на разнообразие и сложность строения животного мира. В настоящее время принято считать, что движущей силой клеточного разнообразия является более глобальная регуляция синтеза белка.
Несомненно, у недоношенных и доношенных новорожденных движущей силой роста и развития является интенсификация синтеза белка. Основной прогресс в понимании того, каким образом нутритивные вещества (в частности, аминокислоты и глюкоза) регулируют синтез белка у недоношенных детей в возрасте до 1 мес, был достигнут с развитием модели новорожденных поросят.
Инфузия меченых аминокислот-маркеров в сочетании с разработанными в молекулярной биологии методами предоставила научному и медицинскому сообществу возможность более глубокого осмысления факторов, контролирующих накопление белков организмом. Кроме того, эти технологические достижения позволили исследовать влияние получаемого с питанием белка на отдельные ткани и органы в естественных условиях.
В эукариотических клетках способность экспрессировать биологически активные, или функциональные, белки попадает под основное регулирование по нескольким пунктам: транскрипция ДНК, обработка РНК, стабильность мРНК, трансляция мРНК и посттрансляционная модификация белка и его сворачивание.
Если бы содержание белков в клетке определялось на уровне транскрипции, взаимозависимость между уровнями белка и мРНК была бы линейной. На самом же деле связь между уровнями мРНК и содержанием белка в одной клетке является слабой, подчеркивая тот факт, что в регуляции содержания белка в клетке доминируют посттранскрипционные процессы. По этой причине двум последним пунктам регулирования (трансляция мРНК и посттрансляционные модификации белков и их сворачивание) в следующих статьях на нашем сайте уделено особое внимание.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Как старение влияет на синтез белка
Как старение влияет на синтез белка
Старая (слева) и молодая (справа) мыши существенно различаются по уровню экспрессии генов, связанных с работой иммунной системы, метаболизмом и способностью организма к восстановлению
Автор
Редактор
В последние годы старение как биологический процесс привлекает все большее внимание молекулярных биологов, которые исследуют, что происходит в стареющем организме на молекулярном уровне. Группа исследователей из НИИ ФХБ имени А.Н. Белозерского, Института молекулярной биологии РАН имени В. А. Энгельгардта и Гарвардской медицинской школы изучила, как в ходе старения изменяются транскрипция и трансляция ряда генов, связанных с работой иммунной системы, метаболизмом и защитой от повреждений, а также описала некоторые любопытные возрастные изменения, затрагивающие динамику трансляции.
Старение как биологический феномен привлекает внимание не только биохакеров, стремящихся максимально увеличить продолжительность жизни, но и молекулярных биологов, занимающихся фундаментальной наукой. И их старания не проходят даром.
Например, сейчас известно, что в ходе жизни организма в его тканях накапливаются неправильно уложенные, окисленные или иным образом модифицированные белки, которые не только не выполняют свою функцию должным образом, но и могут образовывать нерастворимые скопления, нарушающие функционирование целых тканей [1].
Несколько исследований продемонстрировали, что с возрастом в организме в целом снижается интенсивность синтеза белка, уменьшается концентрация факторов инициации и элонгации трансляции, замедляется аминоацилирование тРНК. Сообщается, что в ходе старения происходит интенсивное метилирование промоторов генов рРНК, а концентрация самих рРНК уменьшается [1].
Вместе с тем биологические виды, отличающиеся необычно высокой для своей таксономической группы продолжительностью жизни, как правило, характеризуются очень стабильным протеомом и высокой устойчивостью к окислению белков. Примечательно, что виды, у которых в целом интенсивность синтеза белка понижена, характеризуются повышенной продолжительностью жизни, кроме того, видам-долгожителям вроде голого землекопа [2] часто присущи высокоточный аппарат трансляции и низкий кругооборот белков [1].
Подробнее о существующих теориях старения, влиянии питания на старение и различных аспектах этого любопытнейшего биологического явления читайте в нашем спецпроекте «Старение и долголетие» [5], а также в статьях [6], [7].
О рутинной работе рибосом и их неожиданных функциях читайте в статьях «Рибосома за работой» [8] и «Чего вы не знаете о рибосоме. » [9]. — Ред.
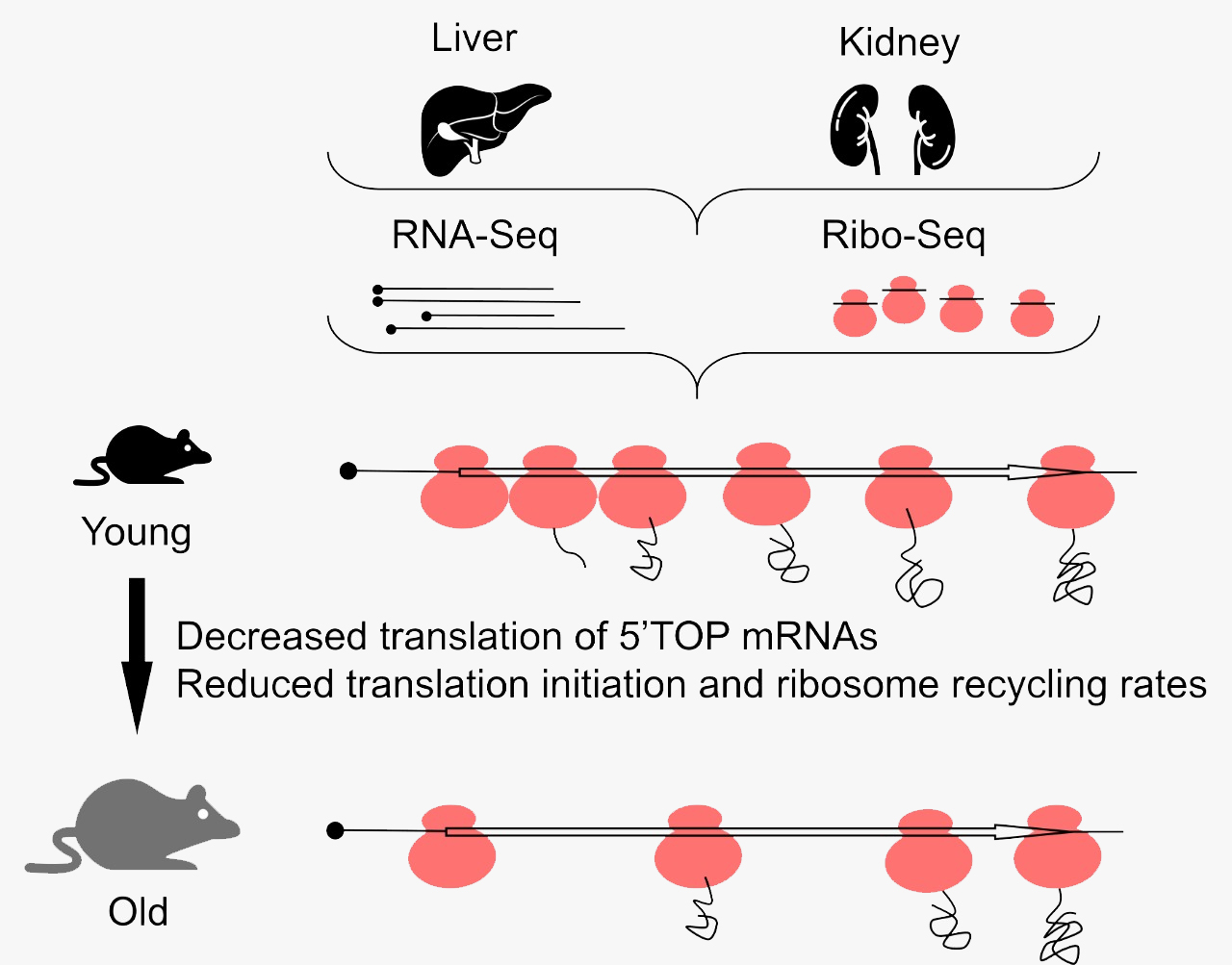
Рисунок 1. Схема исследования, проведенного авторами статьи. Ткани почек и печени, взятые от мышей различных возрастов, были проанализированы с помощью секвенирования РНК и рибосомного профайлинга. Полученные данные позволили оценить, какой вклад вносит трансляция в возрастные изменения экспрессии генов и установить некоторые другие любопытные эффекты, связанные с возрастными изменениями трансляции.
схема выполнена авторами обсуждаемой публикации
Так, по данным экспериментов, в печени и почках мышей с возрастом заметно повышается экспрессия генов, связанных с воспалением и другими иммунными процессами, что соответствует представлениям о развитии хронического воспаления. Сравнив свои данные с результатами более ранних работ на эту тему, авторы смогли выявить четкую и устойчивую возрастную зависимость уровня экспрессии пяти генов, связанных с воспалением и лизосомной деградацией белков (Ctss, C1qa, C1qb, C1qc и Laptm5), так что их можно рассматривать в качестве потенциальных биомаркеров старения.
В отличие от воспалительных процессов, функции митохондрий с возрастом не усиливаются, а угасают. Постепенное возрастное снижение экспрессии некоторых ядерных генов, кодирующих митохондриальные белки, было обнаружено в клетках почек (в клетках печени тоже наблюдалось, но оказалось менее выраженным). Кроме того, синтез компонентов, ответственных за поддержание окислительно-восстановительного баланса, менялся и в печени, и в почках, что хорошо согласуется с широко распространенной теорией о роли окислительного стресса в процессе старения. В то же время в обеих тканях удалось выявить возрастное увеличение экспрессии генов, связанных с регуляцией давления в кровеносных сосудах, а также генов, кодирующих предшественники амилоидов. Также с возрастом в почках снижается синтез белков, связанных с ответом на глюкокортикоидные гормоны, биосинтезом кофакторов и метаболизмом липидов. Примечательно возрастное снижение экспрессии в почках двадцати одного гена компонентов пероксисом, что также согласуется с текущим взглядом на роль возрастных изменений в метаболизме липидов и развитии некоторых заболеваний почек.
О том, как работают митохондрии и какую роль они играют в жизни клетки и целого организма, повествует спецпроект «Биоэнергетика». — Ред.
В общем и целом, большинство возрастных изменений уровня трансляции коррелирует с изменениями уровня транскрипции как в печени, так и в почках, поэтому, вероятнее всего, ключевые изменения экспрессии генов, связанные со старением, происходят именно на уровне транскрипции. Авторы исследования сумели выявить несколько транскрипционных факторов, которые, предположительно, отвечают за возрастные изменения транскрипции. Бóльшая часть генов-мишеней этих факторов задействована в функционировании иммунной системы и воспалении. Многие из транскрипционных факторов, отвечающих за возрастные изменения профилей транскрипции, оказались общими для печени и почек, но среди них есть и тканеспецифичные факторы. В частности, в почках многие транскрипционные факторы, изменяющие профили транскрипции с возрастом, так или иначе связаны с метаболизмом липидов и функционированием пероксисом.
Авторы работы впервые продемонстрировали, что многие гены, экспрессия которых понижается по мере старения организма, связаны с биосинтезом белка, метаболизмом некодирующих РНК и образованием рибосом. В их числе есть гены рибосомных белков, транскрипционных факторов, а также компонентов, задействованных в биогенезе рРНК и рибосом, процессинге некодирующих РНК и других процессах, имеющих ключевое значение для экспрессии генов и ее регуляции. Стоит отметить, что предыдущие исследования, рассматривавшие преимущественно только транскрипционные возрастные изменения, не могли выявить снижение синтеза этих белков, поскольку оно связано с подавлением трансляции, а не транскрипции.
Некодирующие РНК, впрочем, могут кодировать, вопреки своему названию, функциональные пептиды [10]. Примечательно, что длинные некодирующие РНК есть и у бактерий [11], хотя об их функциях известно гораздо меньше, чем о функциях длинных некодирующих РНК эукариот.
Для того чтобы данные по трансляции с определенных мРНК можно было сравнивать не только с аналогичными данными для организма другого возраста, но и с данными по трансляции с других транскриптов, авторы работы использовали специальную нормированную метрику — «занятость» рибосом (RO от англ. ribosome occupancy). Для каждого гена RO вычисляется как количество рибосом, «пойманных» на синтезе его белкового продукта, деленное на общее количество транскриптов гена. Иными словами, RO позволяет понять, насколько интенсивно, по сравнению с другими генами, рибосомы взаимодействуют с мРНК данного гена и синтезируют белок по ее матрице (как правило, чем больше рибосом «сидят» на мРНК гена, тем больше белка с него синтезируется).
Анализ данных рибосомного профайлинга, переведенных в термины RO, показал, что с возрастом и в печени, и в почках увеличивается трансляция с мРНК, связанных с воспалением и дифференцировкой клеток различных типов. В то же время в почках с возрастом заметно снижается экспрессия генов, связанных с образованием и функционированием митохондрий, таких как гены компонентов электрон-транспортной цепи [12]. Примечательно, что трансляция многих ядерных генов, кодирующих белки митохондриального назначения, регулируется сигнальным путем mTOR, причем главную роль в этом процессе играет белок 4E-BP1. Этот же белок отвечает за возрастное снижение экспрессии гена интерферонового регуляторного транскрипционного фактора 7 (Irf7). С возрастом показатель RO для этого гена снижается почти в шесть раз. Стоит отметить, что по мере старения в печени увеличивается синтез субъединиц важнейшего регулятора метаболизма железа — ферритина [13], — трансляция которых зависит от особого железозависимого элемента в 5′-нетранслируемых областях их транскриптов. Вероятно, этот эффект связан с хорошо известными возрастными нарушениями метаболизма и запасания железа, которые зачастую являются последствиями возрастного хронического воспаления. Дело в том, что у грызунов по мере старения в тканях организма накапливается железо, а повышение его концентрации приводит к активации экспрессии гена ферритина и других генов, имеющих железозависимый элемент.
Активная работа mTOR не только поддерживает клеточный цикл и трансляцию белка, но и ухудшает процесс аутофагии [14] — избавления клетки от накопившегося за всю её жизнь «мусора» (дефектных и ненужных молекул). В том числе и поэтому ингибирование mTOR (и, как следствие, интенсификация аутофагии) приводит к увеличению продолжительности жизни модельных животных. — Ред.
Но самый неожиданный и любопытный эффект старения, который выявили авторы работы, состоит в перераспределении рибосом на транскриптах. Оказалось, что с возрастом частота встречаемости рибосом на 5′-концах транскриптов падает и увеличивается на 3′-концах как в печени, так и в почках. Для мышиной печени «точкой невозврата» является возраст 11 месяцев, после которого локализация рибосом становится сильно «перекошенной» в сторону 3′-конца. Особенно выражен эффект смещения рибосом при сравнении образцов тканей от мышей возрастом 11 месяцев и 32 месяца. Наиболее яркий эффект смещения рибосом — вблизи старт- и стоп-кодонов, но его можно пронаблюдать и по всей длине транскрипта.
Один из авторов работы, Сергей Дмитриев, комментирует ее результаты следующим образом: «Наверное, наиболее важным результатом нашей работы с точки зрения понимания механизмов старения является то, что мы показали существенное падение уровня синтеза компонентов трансляционного аппарата в органах стареющих мышей. Интенсивность наработки некоторых рибосомных белков в печени 32-месячных грызунов, например, оказалась в три раза ниже, чем у молодых животных. Причем это снижение происходит именно благодаря регуляции трансляции, поэтому до нас оно не было замечено. То, что белковый синтез у “пожилых” животных идет менее интенсивно, было известно и раньше — но теперь стало понятно, почему это происходит: в клетке просто производится меньше “машин” для биосинтеза белка. Интересный аспект всего этого — что в этой регуляции, по-видимому, замешана протеинкиназа mTOR, которую уже давно “подозревают в связях” со старением. Существуют фармакологические ингибиторы этой киназы (например, рапамицин), которые значимо продлевают жизнь многим модельным организмам. Правда, здесь мы сталкиваемся с парадоксом: с одной стороны, снижение активности белкового синтеза такими лекарствами продлевает жизнь, а с другой — пониженная активность, по нашим данным, характерна как раз для старых животных. Объяснением могло бы быть то, что падение скорости синтеза белка — это не причина старения, а следствие, попытка организма справиться с меняющимися условиями (накоплением в клетке всякого “мусора” и “поломок” — в частности, неправильных белков). Понятно, что когда в квартире не делают уборку, то можно прожить в ней чуточку дольше, если меньше мусорить. Именно это, по-видимому, делает стареющая клетка, и точно так же работают продлевающие жизнь ингибиторы mTOR. К сожалению, эта стратегия лишь отодвигает печальный финал: рано или поздно мусор погребет под собой постояльца. А как провести в клетке “генеральную уборку”, мы пока не придумали».
Параграф 85. регуляция синтеза белка
Автор текстов – Анисимова Е.С.
Продавать тексты нельзя (авторские права защищены). Курсив не зубрите.
Замечания можно присылать по почте: exam_bch@mail.ru
https://vk.com/bch_5
См. сначала п.81, 83, 100-108.
ПАРАГРАФ 85.:
«Регуляция синтеза белка».
85. 1. Регуляция биосинтеза белка у эукариот. (п.81)
Синтез белка регулируется на разных этапах:
регулируются синтез и процессинг РНК,
трансляция
и посттрансляционная модификация.
Но в первую очередь регулируется синтез про-РНК – транскрипция.
От активности транскрипции зависит концентрация РНК –
чем активнее транскрипция, тем больше РНК и тем быстрее может синтезироваться белок.
Скорость транскрипции зависит от того, может ли работать фермент транскрипции –
РНК-полимераза.
В частности, от того, может ли РНК-полимераза связаться с тем участком ДНК перед гЕном,
с которого начинается транскрипция и который называется ПРОМОТОРОМ.
Кроме РНК-полимеразы,
для транскрипции нужен еще ряд белков,
минимальный набор которых называется базальным транскрипционным комплексом (БАК).
Работа БАКа и РНК-полимеразы регулируется специальным белком, который называется КОАКТИВАТОРОМ.
Активность коактиватора регулируется рядом белков,
которые называются транскрипционными факторами (ТФ)
и связываются со специальными участками ДНК,
которые называются регуляторными участками ДНК или реактивными элементами ДНК.
Участки ДНК, связывание с которыми транскрипционных факторов ускоряет транскрипцию,
называются ЭНХАНСЕРАМИ (в переводе – «усилителями»),
а участки ДНК, связывание с которыми замедляет транскрипцию,
называются САЙЛЕНСЕРАМИ (от «сайленс» – тишина).
Способность транскрипционных факторов регулировать транскрипцию, связываться с коактиватором и с регуляторными участками ДНК регулируется:
1) присоединением к ним и отщеплением от них фосфата (фосфорилированием и дефосфорилированием – п.6),
2) протеинкиназами и протеинфосфатазами,
3) присоединением гидрофобных гормонов к ТФ
(такие ТФ, с которыми связываются гидрофобные гормоны, являются рецепторами гидрофобных гормонов).
85. 2. Регуляция синтеза белка гормонами.
Гормоны, стимулирующие синтез белка
(«анаболические»),
способствуют процессам заживления, роста, увеличению мышечной массы.
Примеры – половые гормоны, андрогены сетчатой зоны, инсулин, СТГ, ИФР, ФРК, йодтиронины в нормальных концентрациях.
Андрогены сетчатой зоны применяют при дистрофии, переломах, инфаркте, для заживления язв.
Из-за большего количества андрогенов мышечная масса у мужчин больше, чем у женщин.
При дефиците инсулина (п.102 и 103) снижение синтеза белка приводит к риску гангрены, замедленному заживлению.
Дефицит СТГ и ИФР (п.100) приводит к карликовости.
Дефицит ФРК может стать причиной денегеративных заболеваний,
а применение ФРК может помочь вылечить их.
Гормоны, стимулирующие распад белка
(протеолиз, «катаболические»), препятствуют процессам заживления, роста, увеличению мышечной массы.
Примеры – гормоны СТРЕССА катехоламины (адреналин), ГКС
и стимулятор синтеза ГКС – АКТГ, йодтиронины в высоких концентрациях (при гипертиреозе).
Из-за стимуляции распада белков соединительной ткани ГКС способствуют развитию остеопороза,
а стимуляция распада белков лимфоидной ткани снижает иммунитет – п.108.
М Е Х А Н И З М влияния гормонов на синтез белка. См. п.92-95.
Гидрофобные гормоны
(йодтиронины, ГКС, половые и др.) влияют на синтез белков,
связываясь со своими рецепторами внутри клетки,
которые являются транскрипционными факторами:
связываются со специальными (регуляторными) участками ДНК
и со специальным белком, который называется коактиватором.
Коактиватор связывается с белками базального транскрипционного комплекса,
который участвует в транскрипции (синтезе (про-)РНК).
Регулируя синтез РНК, коактиватор регулирует количество РНК
и возможность синтеза кодируемого этой мРНК белка.
Гидрофильные гормоны влияют на синтез РНК и белка,
связываясь с рецепторами на мембране и передавая сигнал транскрипционным факторам через вторые посредники и протеинкиназы – см. п. 93-95.
85. 2. И Н Д У К Ц И И И Р Е П Р Е С С И И
Синтез белка можно ускорить и в итоге увеличить концентрацию белка.
И, наоборот, синтез белка можно замедлить и в итоге увеличить концентрацию белка.
Ускорение синтеза белка,
ведущее к увеличению концентрации белка,
называется ИНДУКЦИЕЙ.
Замедление синтеза белка,
ведущее к снижению концентрации белка,
называется РЕПРЕССИЕЙ.
Факторы, под влиянием которых происходит индукция, называются ИНДУКТОРАМИ,
а факторы, под влиянием которых происходит репрессия, называются РЕПРЕССОРАМИ.
Индукторы и репрессоры влияют на синтез белка чаще всего
за счет изменения скорости транскрипции,
но могут изменять и скорость трансляции.
Известны разные индукторы и репрессоры,
в зависимости от типа которых различают ряд форм индукции и репрессии:
Ф о р м ы и н д у к ц и и и р е п р е с с и и
1. Субстратная индукция и катаболитная репрессия.
Если индуктором является субстрат фермента,
то индукция называется СУБСТРАТНОЙ.
Пример субстратной индукции – индуктором синтеза амилазы является ее субстрат – крахмал (п.30).
У грудных детей амилаза (п.30) не вырабатывается,
потому что амилаза им не нужна (в молоке крахмала нет, для переваривания которого нужна амилаза).
Необходимость в выработке амилазы появляется при появлении в пище крахмала,
и амилаза начинается вырабатываться под действием крахмала,
когда ребенка начинают кормить кашами, пюре.
Все знают, что накормить грудного ребёнка тарелкой каши при первом же кормлении нельзя,
что введение прикорма должно быть постепенным –
это связано с тем, что выработка амилазы увеличивается постепенно.
При длительном голодании выработка пищеварительных ферментов снижается,
поэтому после длительного голодания человеку нельзя много есть –
в начале можно есть только понемногу.
Продукты реакций (и метаболических путей) обычно снижают эти реакции –
это пример регуляции по принципу отрицательной обратной связи (п.90).
Скорость реакций снижается за счет снижения активности ферментов
(то есть за счет ингибирования ферментов)
и/или за счет снижения синтеза ферментов (то есть за счет репрессии) – п.6,7.
Репрессия (подавление) синтеза ферментов
под действием продуктов их реакций называется катаболитной репрессией.
При этом продукты реакций могут не быть катаболитами, то есть продуктами катаболизма.
Примеры катаболитной репрессии –
1) снижение синтеза ферментов, синтезирующих нуклеотиды, под действием самих нуклеотидов – п.72,
2) снижение синтеза ключевого фермента синтеза холестерина (ГМГ-КоА редуктазы) под действием холестерина (холестерин является репрессором) – п.48.
2. Гормональная индукция и репрессия
Индукторами и репрессорами бывают гормоны –
в этом случае индукция и репрессия называются ГОРМОНАЛЬНЫМИ.
Примеры гормональной индукции –
ГКС индуцируют синтез ключевых ферментов ГНГ и аминотранфераз,
что приводит к синтезу глюкозы (п.33, 37, 108),
ее поступлению в кровь и возникновению гипергликемии.
Инсулин индуцирует синтез ключевых ферментов гликолиза, что способствует выработке энергии в клетке (п.102).
Пример гормональной репрессии –
инсулин репрессирует синтез ключевых ферментов ГНГ,
что приводит к гипогликемии.
ГКС репрессируют синтез ключевых ферментов гликолиза.
Тестостерон и другие андрогены индуцируют синтез мышечных белков,
что приводит к большей мышечной массе у мужчин.
ГКС репрессируют синтез проопиомеланокортина, что приводит к снижению выработки АКТГ (ООС), эндорфинов и т.д..
3. Лекарственная индукция и репрессия.
Некоторые лекарства индуцируют или репрессируют синтез определенных белков.
Индукция и репрессия синтеза белков под действием лекарств называются ЛЕКАРСТВЕННЫМИ.
Фенобарбитал индуцирует синтез цитохрома Р 450 и ферментов коньюгации – п.118.
Поскольку ферменты коньюгации обезвреживают билирубин (свободный),
то фенобарбитал применяют для индукции синтеза ферментов коньюгации при желтухе новорожденных.
Антибиотики
репрессируют матричные синтезы у бактерий,
что приводит к прекращению размножения и гибели бактерий, то есть к антибактериальному эффекту.
При этом антибиотики не подавляют матричные синтезы человека.
Антибиотики могут подавлять (репрессировать) синтез белка у бактерий,
ингибируя ферменты синтеза белка или РНК.
4. Редокс-индукция и редокс-репрессия.
Активные формы кислорода (АФК, п.27)
индуцируют синтез белков, участвующих в иммунных, воспалительных и аллергических реакциях,
а антиоксиданты (глутатион и другие) репрессируют синтез этих белков.
Это одна из причин, почему при дефиците АФК и избытке иммунитете снижается;
но при избытке АФК и дефиците антиоксидантов иммунитет тоже снижается,
так как избыток АФК приводит к гибели лейкоцитов – п.121.
Индукция под действием АФК
репрессия под действием антиоксидантов
называются РЕДОКС-индукцией и редокс-репрессией.
5. При клеточном шоке усиливается выработка шаперонов – см. п. 83.
.
РЕГУЛЯЦИЯ СИНТЕЗА БЕЛКА
Основным условием существования любых живых организмов является наличие тонкой, гибкой, согласованно действующей системы регуляции, в которой все элементы тесно связаны друг с другом. В белковом синтезе не только количественный и качественный состав белков, но и время синтеза имеют большое значение. От этого зависит приспособление микроорганизмов к условиям окружающей питательной среды как биологической необходимости или приспособление сложного многоклеточного организма к физиологическим потребностям при изменении внутренних и внешних условий.
Клетки живых организмов обладают способностью синтезировать огромное количество разнообразных белков. Однако они никогда не синтезируют все белки. Количество и разнообразие белков, в частности ферментов, определяются степенью их участия в метаболизме. Более того, интенсивность обмена регулируется скоростью синтеза белка и параллельно контролируется аллостерическим путем (см. главу 4). Таким образом, синтез белка регулируется внешними и внутренними факторами и условиями, которые диктуют клетке синтез такого количества белка и такого набора белков, которые необходимы для выполнения физиологических функций. Все это свидетельствует о весьма сложном, тонком и целесообразном механизме регуляции синтеза белка в клетке.
Общую теорию регуляции синтеза белка разработали французские ученые, лауреаты Нобелевской премии Ф. Жакоб и Ж. Моно. Сущность этой теории сводится к «выключению» или «включению» генов как функционирующих единиц, к возможности или невозможности проявления их способности передавать закодированную в структурных генах ДНК генетическую информацию на синтез специфических белков. Эта теория, доказанная в опытах на бактериях, получила широкое признание, хотя в эукариотических клетках механизмы регуляции синтеза белка, вероятнее всего, являются более сложными (см. далее). У бактерий доказана индукция ферментов (синтез ферментов de novo) при добавлении в питательную среду субстратов этих ферментов. Добавление конечных продуктов реакции, образование которых катализируется этими же ферментами, напротив, вызывает уменьшение количества синтезируемых ферментов. Это последнее явление получило название репрессии синтеза ферментов. Оба явления – индукция и репрессия – взаимосвязаны.
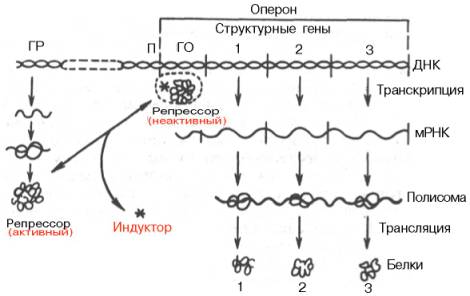
Согласно теории Ф. Жакоба и Ж. Моно, в биосинтезе белка у бактерий участвуют по крайней мере 3 типа генов: структурные гены, ген-регулятор и ген-оператор. Структурные гены определяют первичную структуру синтезируемого белка. Именно эти гены в цепи ДНК являются основой для биосинтеза мРНК, которая затем поступает в рибосому и, как было указано, служит матрицей для биосинтеза белка. Регуляция синтеза белка путем индукции представлена на рис. 14.12.
Синтез мРНК на структурных генах молекулы ДНК непосредственно контролируется определенным участком, называемым геном-оператором. Он служит как бы пусковым механизмом для функционирования структурных генов. Ген-оператор локализован на крайнем отрезке структурного гена или структурных генов, регулируемых им. «Считывание» генетического кода, т.е. формирование мРНК, начинается с промотора – участка ДНК, расположенного рядом с геном-оператором и являющегося точкой инициации для синтеза мРНК, и распространяется последовательно вдоль оператора и структурных генов. Синтезированную молекулу мРНК, кодирующую синтез нескольких разных белков, принято называть полигенным (полицистронным) транскриптом. Координированный одним оператором одиночный ген или группа структурных генов образует оперон.
В свою очередь деятельность оперона находится под контролирующим влиянием другого участка цепи ДНК, получившего название гена-регулятора. Структурные гены и ген-регулятор расположены в разных участках цепи ДНК, поэтому связь между ними, как предполагают Ф. Жакоб и Ж. Моно, осуществляется при помощи вещества-посредника, оказавшегося белком и названного репрессором. Образование репрес-сора происходит в рибосомах ядра на матрице специфической мРНК, синтезированной на гене-регуляторе (рис. 14.13). Репрессор имеет сродство к гену-оператору и обратимо соединяется с ним в комплекс. Образование такого комплекса приводит к блокированию синтеза мРНК и, следовательно, синтеза белка, т.е. функция гена-регулятора состоит в том, чтобы через белок-репрессор прекращать (запрещать) деятельность структурных генов, синтезирующих мРНК. Репрессор, кроме того, обладает способностью строго специфически связываться с определенными низкомолекулярными веществами, называемыми индукторами, или эффекторами. Если такой индуктор соединяется с репрессором, то последний теряет способность связываться с геном-оператором, который, таким образом, выходит из-под контроля гена-регулятора, и начинается синтез мРНК. Это типичный пример отрицательной формы контроля, когда индуктор, соединяясь с белком-репрессором, вызывает изменения его третичной структуры настолько, что репрессор теряет способность связываться с геном-оператором. Процесс этот аналогичен взаимоотношениям алло-стерического центра фермента с эффектором, под влиянием которого изменяется третичная структура фермента и он теряет способность связываться со своим субстратом.
Механизм описанной регуляции синтеза белка и взаимоотношения репрессора со структурными генами были доказаны в опытах с Е. coli на примере синтеза β-галактозидазы (лактазы) – фермента, расщепляющего молочный сахар на глюкозу и галактозу. Дикий штамм Е. coli обычно растет на глюкозе. Если вместо глюкозы в питательную среду добавить лактозу (новый источник энергии и углерода), то штамм не будет расти, пока не будут синтезированы соответствующие ферменты (адаптивный синтез). При поступлении в клетку лактозы (индуктор) молекулы ее связываются с белком-репрессором и блокируют связь между репрессором и геном-оператором. Ген-оператор и структурные гены при этом начинают снова функционировать и синтезировать необходимую мРНК, которая «дает команду» рибосомам синтезировать β-галактозидазу. Одновременно ген-регулятор продолжает вырабатывать репрессор, но последний блокируется новыми молекулами лактозы, поэтому синтез фермента продолжается. Как только молекулы лактозы будут полностью расщеплены, репрессор освобождается и, поступив в ДНК, связывает ген-оператор и блокирует синтез мРНК, а следовательно, синтез β-галактозидазы в рибосомах.
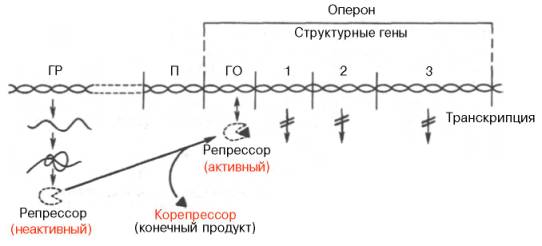
Рис. 14.13. Регуляция синтеза белка путем репрессии (схема). Обозначения те же, что на рис. 14.12.
Таким образом, биосинтез мРНК, контролирующий синтез белка в рибосомах, зависит от функционального состояния репрессора. Этот реп-рессор представляет собой тетрамерный белок с общей мол. массой около 150000. Если он находится в активном состоянии, т.е. не связан с индуктором, то блокирует ген-оператор и синтеза мРНК не происходит. При поступлении метаболита – индуктора – в клетку его молекулы связывают репрессор, превращая его в неактивную форму (или, возможно, снижают его сродство к гену-оператору). Структурные гены выходят из-под запрещающего контроля и начинают синтезировать нужную мРНК.
Как было указано, концентрация ряда ферментов в клетках резко снижается при повышении содержания отдаленных конечных продуктов, образующихся в цепи последовательных ферментативных реакций. Такой эффект, получивший название репрессии ферментов, часто наблюдается при реакциях биосинтеза. В этих случаях молекулы репрессора, также образующиеся в рибосомах ядра по «команде» гена-регулятора, являются неактивными и сами по себе не обладают способностью подавлять деятельность гена-оператора и, следовательно, всего оперона, но приобретают такую способность после образования комплекса с конечным или одним из конечных продуктов биосинтетического процесса (см. рис. 14.13).
Конечный продукт выступает, таким образом, в качестве корепрес-сора. Имеются данные, что в качестве корепрессоров в синтезе ферментов обмена аминокислот, по-видимому, выступает не только свободная аминокислота как конечный продукт биосинтетической реакции, но и комплекс ее с тРНК – аминоацил-тРНК.
В регуляции экспрессии структурных генов специфическое участие принимает особый белок – катаболитный генактивирующий белок (от англ. catabolite gene activation protein, сокращенно CAP). Этот белок, взаимодействующий с цАМФ, образует комплекс, способствующий прикреплению РНК-полимеразы к промоторному участку генома. В присутствии комплекса САР-цАМФ фермент может начать транскрипцию оперона, включая структурные гены, т.е. в клетках имеется еще один, дополнительный САР-цАМФ-регулятор, действующий, скорее всего, в качестве положительного регулятора, поскольку его присутствие необходимо для начала экспрессии гена.
Таким образом, концепция Ф. Жакоба и Ж. Моно о механизме проявления (экспрессии) активности генов признана одним из блестящих достижений молекулярной биологии. Она явилась логическим развитием многочисленных исследований, проведенных генетиками и биохимиками в предшествующие десятилетия.
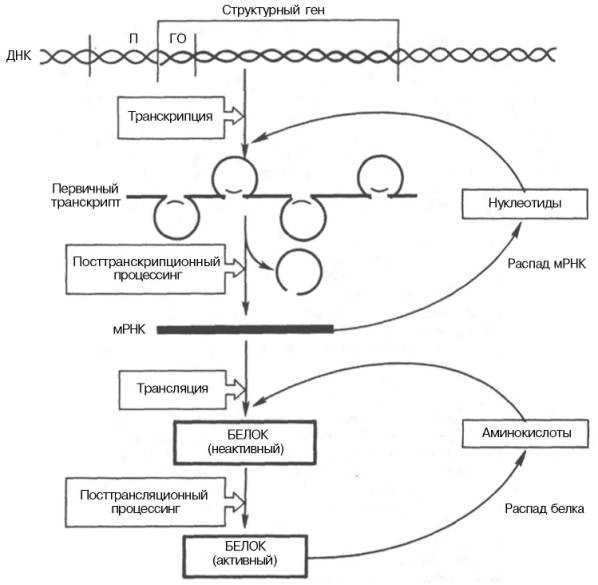
Регуляция экспрессии активности генов у эукариот осуществляется значительно более сложным путем, поскольку процессы транскрипции и трансляции разделены не только пространственно ядерной биомембраной, но и во времени. Эта регуляция базируется как минимум на 6 уровнях сложных биологических процессов, определяющих скорость синтеза и распада генетического продукта (рис. 14.14).
Для большинства эукариотических клеток, как и клеток прокариот, стадия инициации транскрипции является основной, главной регуляторной точкой экспрессии активности генов. Тем не менее имеются существенные различия: во-первых, место процессов транскрипции (в ядре) и трансляции (в цитоплазме); во-вторых, активирование транскрипции у эукари-от связано с множеством сложных изменений структуры хроматина в транскрибируемой области; в-третьих, в эукариотических клетках превалируют положительные регуляторные механизмы над отрицательными.
Положительная или отрицательная регуляция определяется типом белков, вовлеченных в механизм регуляции. Получены доказательства существования минимум 3 типов белков, участвующих в регуляции процесса инициации транскрипции, опосредованного через РНК-полимеразу: специфические факторы, репрессоры и активаторы. Первые вызывают изменение специфичности РНК-полимеразы к данному промотору или группе промоторов; репрессоры связываются с промотором, блокируя тем самым доступ РНК-полимеразы к промотору; активаторы, напротив, связываются вблизи промоторного участка, повышая связывание промотора и РНК-полимеразы.
В многоклеточных организмах среднее число регуляторных сайтов для одного гена минимум равно пяти; положительные регуляторные белки связываются со своими специфическими последовательностями в структуре ДНК (вероятнее всего, посредством водородных связей между амидной группой Глн или Асн и пуриновыми и пиримидиновыми основаниями нуклеотидов). Следует указать еще на один момент, почему эукариоти-ческая клетка использует положительные механизмы регуляции экспрессии генов. Подсчитано, что в геноме человека содержится около 100000 генов, соответственно каждая клетка при отрицательном механизме регуляции могла бы синтезировать 100000 разных репрессоров, причем в достаточных количествах. При положительном механизме регуляции большинство генов в принципе неактивно, соответственно молекула РНК-полимеразы не связывается с промотором и клетка синтезирует ограниченный и избирательный круг активаторных белков, необходимых для инициации транскрипции.
Рис. 14.14. Схематическое изображение регуляции экспрессии активности гена у эукариот.
У эукариот выделены и охарактеризованы также пять регуляторных белков, получивших название транскрипционных факторов (TF: IIА, IIВ, IID, IIЕ и IIF). Они необходимы для узнавания участка (сайта) ДНК, названного TATA (concensus последовательности, ТАТАААА). Детальный молекулярный механизм действия факторов транскрипции пока не раскрыт.
Более подробно в структурном и функциональном отношении у эука-риот изучена группа белков, получивших название белков – активаторов транскрипции. Эти белки имеют специфические структурные домены для связывания с другими, но определенными регуляторными нуклеотидными последовательностями в молекуле ДНК. В частности, они содержат домен, специфически связывающийся с ДНК, и один или несколько доменов, необходимых для активирования или взаимодействия с другими регуляторными белками. Среди этих белков – активаторов транскрипции имеются белки, содержащие богатые глутамином домены (до 25%) и богатые пролином домены. Следует отметить, однако, что некоторые из них или почти все регуляторные белки активируют транскрипцию не прямо, а опосредованно – через промежуточные белки, названные коактиваторами. Происхождение и механизм действия последних также не выяснены.
Современные знания о механизмах регуляции экспрессии генов на посттранскрипционном и посттрансляционном уровнях (см. рис. 14.4) были подробно рассмотрены ранее (см. главы 13 и 14).
Рассмотрим кратко вопрос о регуляции процессов дифференцировки клеток высших организмов. ДНК, присутствующая во всех соматических клетках, вероятнее всего, имеет одинаковую первичную структуру у данного организма и соответственно располагает информацией для синтеза любых или всех белков тела. Тем не менее клетки печени, например, синтезируют сывороточные белки, а клетки молочной железы – белки молока. Нет сомнения в том, что в дифференцированных клетках имеется весьма тонкий механизм контроля деятельности ДНК в разных тканях, обеспечивающий синтез многообразия белков.
Механизмы, лежащие в основе этой регуляции, пока неизвестны. Для их объяснения существует ряд гипотез. Предполагают, что контроль осуществляется на уровне транскрипции по аналогии с индукцией ферментов у бактерий и что в этом случае в клетках животных должны функционировать аналогичные репрессоры. С молекулой ДНК у эукариот связаны гистоны, поэтому считается, что именно эти белки выполняют роль репрессоров. Прямых доказательств их роли в качестве репрессоров не получено, хотя, как было показано, в клетках эукариот открыт класс регуляторных белков процесса транскрипции. Высказано предположение, что в ядре синтезируется высокомолекулярная молекула мРНК, содержащая информацию для синтеза широкого разнообразия белков, но в цитоплазму попадает только небольшая часть зрелой мРНК, а основная часть ее распадается. Неясны, однако, биологический смысл и назначение этого механизма избирательного распада и соответственно траты огромной массы молекулы мРНК.
Существует еще одно предположение, что на ДНК клетки синтезируются все мыслимые, возможные мРНК, которые поступают в цитоплазму, и процесс трансляции регулируется путем специфического и избирательного взаимодействия рибосом с определенными молекулами мРНК.