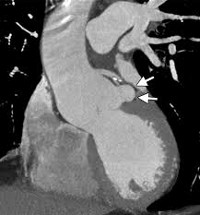
Синдром вальсальвы это что
Случай успешного проведения операции Bentall-de-Bono при аневризме синусов Вальсальвы
Случай успешного проведения операции Bentall-de-Bono при аневризме синусов Вальсальвы
В отдел Телемедицины Научного Центра Сердечно-Сосудистой хирургии им. А.Н. Бакулева поступила выписка на пациента 52 лет из г. Ижевска с диагнозом:
«Врожденный порок сердца. Аневризма синуса Вальсальвы. Недостаточность аортального клапана 1-2 степени. Хроническая сердечная недостаточность 1 степени, функциональный класс 2. Гипертоническая болезнь 2 степени, 2 стадии, риск 4».
Обследование по месту жительства
Больной страдает артериальной гипертензией более 10 лет. Максимальные цифры артериального давления (АД) 160/90 мм. рт. ст. Адаптирован к 120/70 мм. рт. ст. Гипотензивную терапию получал нерегулярно. С 44 лет отмечает ноющие боли в левой половине грудной клетки с иррадиацией в левую лопатку. Обратился к кардиологу по месту жительства, при обследовании выявлено расширение синусов Вальсальвы. Оперативное лечение не предлагалось. Систематически наблюдался у кардиолога. При плановом обследовании в возрасте 52 лет была отмечена отрицательная динамика, выявлена аневризма аорты. Был госпитализирован для решения вопроса о коррекции врожденного порока сердца.
На момент осмотра жалоб не предъявляет.
Объективный осмотр: Состояние удовлетворительное, адекватен, контактен. Нормостенического телосложения. Кожные покровы физиологической окраски. Отеков нет. Периферические лимфоузлы не увеличены. В легких дыхание везикулярное, хрипов нет. Тоны сердца ритмичные, приглушены. Протодиастолический шум в точке Боткина. АД 120/70 мм. рт. ст. Частота сердечных сокращений (ЧСС) 72/мин. Живот мягкий, безболезненный. Печень не увеличена.
Проведенные исследования:
Холтеровское мониторирование: Синусовый ритм с частотой 39-131/мин. Вертикальное положение электрической оси сердца. Зарегистрированы: одиночная редкая желудочковая экстрасистолия; одиночная редкая наджелудочковая экстрасистолия. Ишемические изменения не выявлены.
Аневризма синуса вальсальвы
Аневризма синуса Вальсальвы: виды, причины, симптомы, диагностика, лечение и профилактика
Аневризма синуса Вальсальвы представляет собой болезненные сердечные пороки, осложняющиеся сердечной недостаточностью у пациентов. Заболевание прогрессирует в случае разрыва аневризмы и синуса Вальсальвы, патология сопровождается болевыми ощущениями в грудной области и увеличением всяческих недомоганий, также болезни появляется одышка.
Современная медицина считает, что заболевание является одним из самых редких. Также оно возникает в основном у пациентов, страдающих от сердечных заболеваний. Сегодня данную болезнь классифицирует следующим способом:
1) С разрывом изъянистых синусов в межпредсердном средостении;
2) С патологическим разрывом межжелудочковой территории;
3) Недостаточность в аорте;
4) С открытыми аортными протоками;
5) С коарктацией главных артерий.
Причины
Причинами возникновения данного врожденного заболевания являются наследственные признаки. К прообразующим факторам также относятся: родоразрешение с осложнениями, трудное ношение плода, травмирование после родов, а также недоразвитость эмбриона внутри материнской утробы.
Среди других условий образования можно выделить:
Симптомы
Первые признаки проявляются еще в раннем возрасте. Ребенок очень беспокоен, постоянно плачет, у него наблюдаются боли, покалывание, хрипы в груди.
Этот процесс может возникать из-за чрезмерной физической нагрузки. Человеку становится сразу плохо, он может терять сознание, у него бледный вид, сбитое сердцебиение, тошнота и в некоторых случаях кома. После появления первых признаков следует немедленно обратиться к медику.
Выделяют недомогания с постепенным и с резким ухудшением самочувствия. Степень нарушения гемодинамики заключается в определении объема сброса крови, который, в свою очередь, зависит от давления в артерии и диаметра перфорационного отверстия.
Диагностика
Диагностировать эту болезнь может врач (кардиолог или пульмонолог), сделать это он может с помощью: МРТ, кардиограммы, электрокардиографии, фонокардиографии и ЭхоКГ.
ЭКГ не имеет специфических изменений, выявляются признаки гипертрофии мышц обоих желудочков и левого предсердия. Иногда обнаруживаются проявления атриовентрикулярной изоляции, узловой ритм.
Допплероэхография помогает определить положения проксимальной аорты, клапана и окружающей структуры. Данные исследования помогут точно локализовать местоположения шунта и его величину. Трехмерная эхокардиография способствует планированию адекватного хирургического или транскатетерного подхода.
Ретроградная аортография предполагает введение специального компонента в основание артерии, который контрастирует мешкообразное аневризматическое выпячивание, пролабирующее в выводную часть правого желудочка или правого предсердия, через которое компонент поступает в соответствующую часть сердца. У ряда пациентов провисают створки, что обусловливает поступление медикамента в полость левого желудочка, это свидетельствует о сопутствующей сердечной нехватке.
Лечение
Терапия начинается с госпитализации человека в кардиологическое отделение. При такой патологии назначается комплексный подход: медикаментозный способ и способ терапии. В некоторых случаях человека сразу подготавливают к оперативному вмешательству.
Физиатрия при помощи медикаментов направлена на гемодинамическую стабилизацию, предупреждение или устранение эндокардита, аритмии и кардиальной ишемии. Физиатрию осуществляют диуретиками и ингибиторами АПФ. При ишемическом отклонении показано назначение β-адреноблокаторов, нитратов. Проводится стандартное предупреждение инфекционного эндокардита.
Срочная хирургия обязательна, когда диагностируется прорыв данного образования. Совместный подход через поврежденную камеру и со стороны синуса изнутри главной артерии считается самым полезным, чтобы позволить осмотр соответствующей створки и избежать повреждения коронарных сосудов.
Транскатетерное закрытие такого разрыва осуществляется различными устройствами, например, Amplatzer, под контролем эхокардиографии.
Данная патология – это не до конца изученная болезнь сердечно-сосудистой системы. Методы ее устранения не усовершенствованы до уровня окончательного выздоровления.
Профилактика
Профилактический период после операции длительный. Необходимо придерживаться здорового образа жизни. Больше времени проводить на свежем воздухе и регулярно ходить на консультации и обследования доктора.
Аневризма синуса Вальсальвы
Аневризма синуса Вальсальвы – это аортальный порок, выражающийся в аневризматическом выпячивании стенки аорты в области корня, в месте расположения полулунных клапанов. Клиническая симптоматика развивается при разрыве аневризмы синуса Вальсальвы, который может сопровождаться болью в груди, одышкой, нарастанием сердечной недостаточности. Диагноз аневризмы синуса Вальсальвы устанавливается по данным ЭхоКГ, аортографии, МСКТ сердца, МРТ. Лечение аневризмы синуса Вальсальвы заключается в пластике стенок аорты в условиях искусственного кровообращения.
МКБ-10
Общие сведения
Аневризма синуса Вальсальвы – редкая врожденная или приобретенная патология, представляющая собой мешкообразное или пальцеобразное выпячивание аортальных синусов. Наиболее часто в кардиохирургии встречается врожденная форма патологии, на долю которой приходится 0,1—3,5% всех врожденных пороков сердца. Большинство (70-80%) пациентов с врожденной аневризмой синуса Вальсальвы составляют лица мужского пола. Врожденные аневризмы синуса Вальсальвы часто сочетаются с дефектами межжелудочковой перегородки (40—50 %), дефектом межпредсердной перегородки, аортальной недостаточностью, коарктацией аорты, открытым артериальным протоком, стенозом легочной артерии.
Причины
Предполагается, что в основе формирования врожденной аневризмы синуса Вальсальвы лежит слабость соединения стенки аорты с фиброзным кольцом, что обусловливает отслоение средней оболочки аорты (медии) и образование аневризмы. Таким образом, предпосылки формирования аневризмы синуса Вальсальвы могут быть заложены еще в эмбриональном периоде, однако на момент рождения аневризмы, как правило, не обнаруживаются. В течение жизни аневризма увеличивается в размерах, ее стенки постепенно истончаются, что в конечном итоге приводит к перфорации. Разрыв аневризмы синуса Вальсальвы чаще происходит в возрасте 20-40 лет, однако может случиться и у детей раннего возраста.
В качестве причин приобретенных аневризм синуса Вальсальвы называются:
В этих случаях аневризма синуса Вальсальвы вызывается дистрофией соединительной ткани, выстилающей внутреннюю поверхность синуса.
Патоморфология
Симптомы аневризмы
По варианту клинического течения выделяют разрыв аневризмы синуса Вальсальвы с постепенным ухудшением состояния (когда имеет место другой врожденный порок сердца) и с резким ухудшением состояния (при изолированной аневризме аортального синуса). Степень нарушения гемодинамики определяется объемом сброса крови, который, в свою очередь, зависит от давления в аорте и диаметра перфорационного отверстия.
Разрыв аневризмы синуса Вальсальвы может провоцироваться физической нагрузкой, артериальной гипертензией, бактериальным эндокардитом, травмами. Момент прорыва сопровождается появлением болей за грудиной, одышки, тахикардии, артериальной гипотонии, развитием сердечной недостаточности. В остром периоде может развиться отек легких.
Характерными объективными признаками служат систоло-диастолический («машинный») шум над областью сердца, диастолическая гипотензия, систолическое дрожание. Большой сброс крови в правые отделы сердца может вызывать острое переполнение правого желудочка, приводящее к гибели больного.
Диагностика
По данным электрокардиографии специфических признаков аневризмы синуса Вальсальвы не выявляется; в случае прорыва аневризмы отмечается острая перегрузка правых или левых отделов сердца. В доклинической стадии при аускультации отмечается систолический или диастолический шум по левому краю грудины. При фонокардиографии выявляется высокоамплитудный шум, обычно занимающий всю систолу и диастолу. Наиболее информативными методами диагностики служат:
Лечение аневризмы синуса Вальсальвы
При пороках синусов Вальсальвы возможно только хирургическое лечение. В этом случае выполняется пластика аневризмы в условиях искусственного кровообращения. В процессе операции аневризматический мешок прошивается и иссекается; операционный дефект укрывается синтетической заплаткой изнутри соответствующей полости сердца или со стороны аорты. При необходимости операция дополняется пластикой створок или протезированием аортального клапана. Ближайшие и отдаленные послеоперационные результаты удовлетворительные.
Прогноз
То обстоятельство, что аневризма синуса Вальсальвы в большинстве случаев остается нераспознанной до момента разрыва, является фактором, отягощающим прогноз заболевания. При формировании крупной артериовенозной фистулы между аортой и правыми отделами сердца возникает большой сброс крови, довольно быстро приводящий к острой сердечной недостаточности и смерти больного. В тех случаях, когда размер образовавшегося сообщения небольшой, больные живут в среднем 1−2 года, погибая от застойной сердечной недостаточности или бактериального эндокардита.
Клиническое значение малых аномалий развития сердца у детей
В последние годы большое внимание уделяется дисплазии соединительной ткани (ДСТ) у детей. Под ДСТ понимают врожденную аномалию соединительно-тканной структуры различных органов и систем, в основе которой лежит снижение содержания отдельных
В последние годы большое внимание уделяется дисплазии соединительной ткани (ДСТ) у детей. Под ДСТ понимают врожденную аномалию соединительно-тканной структуры различных органов и систем, в основе которой лежит снижение содержания отдельных видов коллагена и/или нарушение их соотношения, приводящее к снижению прочности соединительной ткани [12, 13, 24, 26].
В развитии ДСТ принимают участие эндогенные (хромосомные и генетические дефекты) и экзогенные (неблагоприятная экологическая обстановка, неадекватное питание, стрессы) факторы [12, 30, 43]. Особенность морфогенеза соединительной ткани заключается в том, что она участвует в формировании каркаса сердца практически на всех этапах онтогенеза, следовательно, влияние любого повреждающего фактора может привести к развитию ДСТ сердца [15].
В 1990 г. в классификации заболеваний сердечно-сосудистой системы Нью-Йоркской ассоциации кардиологов, а также в Омске, на симпозиуме, посвященном проблеме дисплазии соединительной ткани, был впервые выделен синдром ДСТ сердца, сопровождающий как дифференцированные, так и недифференцированные ДСТ. При синдроме ДСТ сердца в патологический процесс вовлекается его соединительно-тканный каркас — сердечные клапаны (атриовентрикулярные, полулунные, евстахиев клапан), подклапанный аппарат, перегородки сердца и магистральные сосуды.
В клинической практике, когда речь идет о морфологической основе изменений сердечно-сосудистой системы без гемодинамических нарушений, Ю. М. Белозеровым (1993) и С. Ф. Гнусаевым (1995) вместо термина «ДСТ сердца» был предложен другой — «малые аномалии развития сердца» (МАРС) [3, 8]. Согласно определению этих авторов, МАРС считаются анатомические изменения архитектоники сердца и магистральных сосудов, не приводящие к грубым нарушениям функций сердечно-сосудистой системы [9].
Классификация МАРС по С. Ф. Гнусаеву, 2001 (с изменениями)
предсердия и межпредсердная перегородка: пролабирующий клапан нижней полой вены, увеличенный евстахиев клапан более 1 см, открытое овальное окно, небольшая аневризма межпредсердной перегородки, пролабирующие гребенчатые мышцы в правом предсердии;
трикуспидальный клапан: смещение септальной створки в полость правого желудочка в пределах 10 мм, дилатация правого атриовентрикулярного отверстия, пролапс трикуспидального клапана;
легочная артерия: дилатация ствола легочной артерии, пролапс створок;
аорта: погранично узкий и широкий корень аорты, дилатация синуса Вальсальвы, двустворчатый клапан аорты, асимметрия и пролапс створок клапана аорты;
левый желудочек: трабекулы (поперечная, продольная, диагональная), небольшая аневризма межжелудочковой перегородки;
митральный клапан: пролапс митрального клапана, эктопическое крепление хорд, нарушенное распределение хорд передней и (или) задней створки, «порхающие» хорды, дополнительные и аномально расположенные папиллярные мышцы.
До сих пор нет единого мнения о клиническом значении МАРС, многие из которых имеют нестабильный характер, связанный с ростом ребенка. Так, возможно обратное развитие увеличенного евстахиева клапана, пролабирующих гребенчатых мышц в правом предсердии, пролапса митрального клапана (ПМК), закрытие открытого овального окна, нормализация длины хорд митрального клапана и диаметра магистральных сосудов. В ряде случаев МАРС изменяются не только в качественном, но и в количественном отношении [3]. Превышение установленного порогового уровня сердечной стигматизации у здоровых детей (более 3 МАРС), по мнению С. Ф. Гнусаева (1995), свидетельствует о возможном неблагополучии как в отношении факторов, влияющих на формирование здоровья, так и показателей, характеризующих его [8].
Учитывая, что МАРС являются вариантом висцеральных ДСТ, дети, как правило, имеют выраженный полиморфизм клинико-морфологических нарушений, зависящий от степени ДСТ и вовлечения в патологический процесс других органов и систем. Выявлена ассоциативная связь между числом внешних фенотипических маркеров ДСТ и МАРС [12, 16, 21, 22]. При этом имеют значение не только число внешних фенотипических маркеров, но и «диагностический вес» каждого из них. Отмечено, что дисплазии кожи и скелета наиболее часто сочетаются с МАРС [12].
Клиническая значимость патологии соединительной ткани у лиц с ДСТ подтверждается данными о высокой частоте нейровегетативных расстройств, изменений центральной нервной системы (энурез, дефекты речи, вегетососудистая дистония (ВСД)), нарушений психики [5, 12, 24]. Как правило, у таких пациентов всегда выявляется ВСД, что, вероятно, обусловлено наследуемыми (наследственными) особенностями структуры и функции лимбико-ретикулярного комплекса, определяющими аномальный характер нейровегетативных реакций [12]. Е. В. Буланкиной (2002) установлена отчетливая взаимосвязь между вегетативной дисфункцией и ДСТ [4]. При этом выраженность диспластических изменений сочеталась с тяжестью процессов дезадаптации регуляторных механизмов и снижением стрессовой устойчивости организма. Наиболее распространенными проявлениями вегетативной дисфункции являются цефалгии, вегетативные кризы, вегетовисцеральные пароксизмы, пре- и синкопальные состояния [12, 16]. Согласно данным С. Ф. Гнусаева (1995), у лиц с ПМК выявлена недостаточность сегментарных вегетативных структур [8]. Исследования Т. М. Домницкой (2000) позволили установить прямую зависимость между ПМК, аномально расположенными трабекулами (АРТ) и распространенностью невротических (невротические реакции, невроз навязчивых состояний, панические расстройства) и энцефалопатических (церебрастенический синдром, заикание, тики, нарушения сна, энурез, гипердинамический синдром, страхи) расстройств [10].
Нередко МАРС сопровождают такие патологические состояния, как нарушения сердечного ритма и проводимости, в том числе синдром ранней реполяризации, синдром слабости синусового узла, синдром Вольф–Паркинсон–Уайта, повышение электрической активности левого желудочка, блокада правой ножки пучка Гиса, экстрасистолия и пароксизмальная тахикардия [4, 6, 8, 34]. По данным Л. А. Балыковой и соавт. (2002), у 90% больных с нарушениями сердечного ритма с помощью эхографии были выявлены МАРС (преимущественно ПМК) [2]. Однако не все МАРС сопровождаются нарушениями сердечного ритма и (или) могут являться их причиной. К аритмогенным МАРС относятся фиброзно-мышечные аномально расположенные хорды (АРХ) и АРТ, ПМК и пролапс трикуспидального клапана (ПТК), аневризма межпредсердной перегородки, увеличенный и/или пролабирующий евстахиев клапан.
Наличие проводящих кардиомиоцитов в фиброзно-мышечных АРХ и АРТ формирует дополнительные проводящие пути, чем объясняется происхождение импульса, опережающего внутрижелудочковое проведение и вызывающего раннее возбуждение прилежащих к нему сегментов с последующей их более ранней реполяризацией [12, 15, 19, 20, 28]. Имеется гистологическое подтверждение наличия проводящих клеток в АРТ с диагонально-базальной, срединно-поперечной и продольной локализацией и в АРХ, соединяющих базальные септальные отделы и боковую стенку левого желудочка [3, 10, 33]. M. Suwa и соавт. (1986) отметили возрастание частоты желудочковых экстрасистол с увеличением толщины хорды. По мнению E. Chesler и соавт. (1983), появление желудочковых экстрасистол связано с миксоматозно измененными хордами, вызывающими механическое раздражение стенки левого желудочка [27]. Факт аритмогенности АРХ и АРТ также подтверждается исчезновением у пациентов экстрасистолии в случае их самостоятельного разрыва или оперативного рассечения либо при физической нагрузке, когда уменьшается степень их натяжения [8, 10, 12]. Довольно распространенным нарушением сердечного ритма при АРХ и АРТ является и синдром раннего возбуждения желудочков [6, 12].
Аритмии при ПМК и ПТК, по данным разных авторов, встречаются от 15 до 90% случаев [11]. Среди причин аритмий рассматриваются вегетативные дисфункции, механическая стимуляция эндокарда, дефицит внутритканевого магния, психологический стресс и миксоматозная дегенерация створок клапанов [3, 10–12, 18, 27, 29, 37, 39]. Установлена прямая корреляционная зависимость между частотой, а также степенью тяжести нарушений ритма и глубиной ПМК [1]. Ряд авторов полагают, что причиной развития аритмий при ПМК и ПТК может являться турбулентный поток, возникающий в результате регургитации через клапанное кольцо во время систолы желудочков, особенно при ПТК, когда происходит механическое раздражение зоны синусового узла [3, 8, 23]. Возможным механизмом развития желудочковых экстрасистол при ПМК большинство исследователей считают избыточное натяжение папиллярных мышц вследствие их аномальной тракции при пролабировании створок [12, 14, 25, 38].
Развитие аритмий может провоцировать пролабирующий евстахиев клапан и аневризма межпредсердной перегородки: условия для возникновения аритмий возникают в результате их холмистых движений и рефлекторного раздражения ими пейсмекерных образований в правом предсердии [42].
Согласно исследованиям О. А. Дианова (1999), нарушения сердечного ритма встречались у детей с погранично узкой аортой, у которых в 32,4% случаев регистрировалась суправентрикулярная и в 10,8% — желудочковая экстрасистолии, свидетельствующие о декомпенсации адаптации, особенно в условиях физической нагрузки [4].
По данным Ю. М. Белозерова, дети с МАРС отличаются сниженными возможностями кардиогемодинамики и демонстрируют плохую переносимость физических нагрузок [3]. По данным Н. А. Мазура, установлена связь между ПМК и синдромом внезапной смерти у взрослых. Накоплено достаточно сведений о том, что дети с МАРС относятся к группе риска по развитию инфекционного эндокардита.
Таким образом, существующие результаты исследований о том, что МАРС в ряде случаев являются основой кардиоваскулярной патологии у детей. В то же время неоправданным было бы преувеличение их роли в функциональных нарушениях сердечно-сосудистой системы. Очевидно, в каждом конкретном случае значимость структурных аномалий сердца должна рассматриваться индивидуально.
Принципы терапии детей с МАРС еще до конца не сформулированы. Однако на сегодняшний день можно предложить следующую тактику ведения детей с МАРС:
Общепризнанным является применение немедикаментозных методов лечения, включающих:
Вопрос о допуске к занятиям спортом решается индивидуально. При наличии ПМК необходимо учитывать семейный анамнез (случаи внезапной смерти у родственников), наличие жалоб на сердцебиения, кардиалгии; синкопальные состояния; изменения на ЭКГ (нарушения сердечного ритма, синдром укороченного и удлиненного QT) являются основанием для принятия решения о противопоказании спортивных тренировок. Это касается и наличия АРХ, АРТ с синдромом раннего возбуждения желудочков, которые, являясь аритмогенными МАРС, могут спровоцировать нарушения сердечного ритма у спортсменов в условиях физического и психоэмоционального напряжения.
Медикаментозное лечение включает применение:
В настоящее время терапия препаратами магния при МАРС приближается к патогенетической. Это обусловлено тем, что магний входит в состав основного вещества соединительной ткани и необходим для правильного формирования волокон коллагена. В условиях магниевой недостаточности нарушается способность фибробластов продуцировать коллаген [29, 31]. Кроме того, магний оказывает мембраностабилизирующее действие, удерживает калий внутри клетки, препятствует симпатикотоническим влияниям, что делает возможным его применение для лечения нарушений сердечного ритма [40, 41].
В работах О. Б. Степуры (1999), О. Д. Остроумовой и соавт. (2004) имеются сведения о достоверном уменьшении степени ПМК, симптомов ВСД, количества желудочковых экстрасистол на фоне терапии препаратами магния [17, 18].
Целесообразным может быть признано назначение следующих препаратов:
Магнерота, содержащего соль магния и оротовую кислоту. Последняя не только усиливает реабсорбцию Mg в кишечнике, но и обладает самостоятельным метаболическим действием. Детям назначают по 500 мг магнерота (32,8 мг магния 3 раза в день в течение 1 нед, затем 250 мг 3 раза в день в течение последующих 5 нед. Принимается препарат за 1 ч до еды).
Магне В6. Выпускается в таблетках (48 мг магния или в растворе для приема внутрь (100 мг магния). Детям с массой тела более 10 кг (старше 1 года) — 5–10 мг/кг/сутки в 2–3 приема. Детям старше 12 лет — 3–4 табл. в сут, в 2–3 приема. Продолжительность курса 6–8 нед.
Калия оротата. Детям препарат назначают из расчета 10–20 мг/кг/сут в 2–3 приема за 1 ч до еды или через 4 ч после еды. Продолжительность курса — 1 мес.
Следует проводить повторные курсы терапии этими препаратами (3–4 раза в год).
Для улучшения клеточной энергетикии миокарда применяют препараты, обладающие комплексным влиянием на метаболические процессы в организме, а также являющиеся активными антиоксидантами и мембраностабилизаторами:
Кроме указанных препаратов для улучшения метаболических процессов в соединительной ткани, миокарде и в организме в целом показано применение:
Показаны повторные курсы лечения (до 3 раз в год).
При наличии ВСД проводится комплексная длительная терапия по восстановлению баланса между симпатическим и парасимпатическим отделами вегетативной нервной системы (дифференцированная фитотерапия, вегетотропные препараты, ноотропы, вазоактивные препараты — кавинтон, вазобрал, инстенон, циннаризин и др.).
Таким образом, все вышесказанное позволяет сделать вывод, что МАРС, являясь висцеральным проявлением дисплазии соединительной ткани, составляют морфологическую основу функциональных изменений сердечной деятельности и нейровегетативных расстройств. Выбор индивидуальной программы курсового лечения способствует улучшению обменных процессов в соединительной ткани и профилактирует возможные осложнения ДСТ у детей и подростков.
По вопросам литературы обращайтесь в редакцию.
Н. А. Коровина, доктор медицинских наук, профессор
А. А. Тарасова, кандидат медицинских наук, доцент
Т. М. Творогова, кандидат медицинских наук, доцент
Л. П. Гаврюшова, кандидат медицинских наук, доцент
М. С. Дзис
РМАПО, Москва