Синдром цельвегера что такое простыми словами
Синдром цельвегера что такое простыми словами
Синдром Цельвегера (цереброгепаторенальный синдром). Это редкое заболевание с летальным исходом передается по аутосомно-рецессивному типу. Синдром Цельвегера служит прототипом группы пероксисомных заболеваний, имеющих сходные клинические проявления и биохимические нарушения. У младенцев с синдромом Цельвегера дизморфия лица, включая выпуклость в лобной области и крупный передний родничок. Затылок уплощен, характерны аномалии ушных раковин. Как правило, выявляются готическое нёбо, чрезмерное развитие кожных складок шеи, выраженная мышечная гипотония и арефлексия.
При офтальмологическом исследовании — нистагмоидные движения глаз при зрительном слежении, билатеральная катаракта и атрофия дисков зрительных нервов. Генерализованные эпилептические приступы проявляются в раннем возрасте и сочетаются с тяжелой глобальной задержкой развития, выраженным двусторонним снижением слуха. Причиной тяжелых неврологических нарушений служит остановка миграции нейробластов на ранних этапах развития, приводящая к церебральной пахигирии и нейрональной гетеротопии. Гепатомегалия возникает вскоре после рождения, часто сочетается с длительной желтухой новорожденных в анамнезе. Летальный исход чаще наступает на первом году жизни.
Нейродегенеративные заболевания у детей
Нейродегенеративные заболевания с дебютом в детском возрасте включают в себя большую гетерогенную группу заболеваний, в основе которых лежат специфические генетические или биохимические нарушения, хронические вирусные инфекции, а также значительную группу состояний неизвестной этиологии. В прошлом при подозрении на нейродегенеративное заболевание в детском возрасте проводилась биопсия мозга и прямой кишки, однако в связи с прогрессом в развитии современных методов нейровизуализации и специфических биохимических молекулярно-диагностических тестов, необходимость в применении этих инвазивных диагностических методов стала возникать редко.
Наиболее важными компонентами обследования остаются тщательно собранный анамнез и физи-кальное обследование. Отличительная особенность нейродегенеративного заболевания — прогрессирующее нарушение функций нервной системы с потерей речи, зрения, слуха, двигательной функции, часто в сочетании с эпилептическими приступами, нарушением питания и снижением интеллекта. Возраст пациента в дебюте болезни, скорость прогрессирования и основные неврологические проявления определяют преимущественное поражение белого или серого вещества мозга.
В первом случае на ранней стадии заболевания появляются признаки поражения пирамидных путей, при поражении серого вещества — выражены эпилептические приступы, снижение интеллекта и нарушение зрения. Точно собранный анамнез подтверждает регрессию приобретенных навыков, неврологическое исследование позволяет локализовать патологический процесс в нервной системе. Хотя нейродегенеративные заболевания, как правило, заканчиваются летальным исходом и терапия обычно неэффективна, правильная диагностика имеет большое значение для генетического консультирования и применения профилактических стратегий.
Трансплантация костного мозга и другие методы клеточной и генной терапии получают распространение, как методы, предотвращающие прогрессирование заболевания у пациентов, находящихся на пресимптомной стадии. Для всех заболеваний, при которых известен специфический ферментный дефект, разработана пренатальная диагностика (амниоцентез или биопсия ворсин хориона). Во многих случаях с помощью ферментного анализа можно выявить носителей заболевания.
Наследственные нейродегенеративные заболевания включают сфинголипидозы, нейрональный цероидлипофусциноз, АЛД и сиалидоз. Сфинголипидозы характеризуются внутриклеточным накоплением нормальных липидных компонентов клеточной мембраны в результате нарушения их катаболизма. Сфинголипидозы подразделяются на шесть категорий: болезнь Ниманна-Пика, болезнь Гоше, GM1-ганглиозидоз, GМ2-ганглиозидоз, болезнь Краббе и метахроматическая лейкодистрофия.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Синдром Цельвегера
Весь контент iLive проверяется медицинскими экспертами, чтобы обеспечить максимально возможную точность и соответствие фактам.
У нас есть строгие правила по выбору источников информации и мы ссылаемся только на авторитетные сайты, академические исследовательские институты и, по возможности, доказанные медицинские исследования. Обратите внимание, что цифры в скобках ([1], [2] и т. д.) являются интерактивными ссылками на такие исследования.
Если вы считаете, что какой-либо из наших материалов является неточным, устаревшим или иным образом сомнительным, выберите его и нажмите Ctrl + Enter.
Синдром Цельвегера является довольно тяжелым наследственным заболеванием.
Среди врачей также носит название цереброгепаторенальный синдром. Главной причиной болезни считается нехватка пероксисом в тканях организма.
Причины синдрома Цельвегера

Патогенез
Синдром Цельвегера является довольно редким заболеванием. Оно является прототипом пероксисомных болезней, которые проявляются с одинаковыми или похожими симптомами и нарушениями в биохимическом плане. У детей, которые болеют на синдром Цельвегера, заметна дизморфия лицевых костей: в лобной области появляется сильная выпуклость, а передний родничок отличается слишком большим размером. Ушные раковины часто развиваются аномально, а затылок слишком уплощенный. На шее развивается много складок кожи, небо – готическое, сильно заметная арефлексия и гипотония мышц.

Симптомы синдрома Цельвегера
Основными патогномоничными симптомами данного заболевания можно выделить такие:
Первые признаки
Болезнь начинает развиваться еще в неонатальном периоде. Первые признаки синдрома Цельвегера проявляются уже с самого рождения. Во-первых, вес новорожденного, больного на данную тяжелую болезнь, не превышает 2500 грамм. Строение лица довольно характерно для заболевания и отличается дисморфизмом. Все больные страдают на нарушение развития головного мозга. Могут проявляться пороки сердца и наружных половых органов.

Осложнения и последствия
К сожалению, последствия синдрома Цельвегера являются неутешительными. Во-первых, данная болезнь является причиной развития многих других довольно тяжелых заболеваний. Практически с первых же дней жизни младенцы болеют на желтуху, у них проявляются различные пороки и аномалии. Очень часто врачи замечают у пациентов гидроцефалию, лизэнцефалию и полимикрогирию. На данный момент последствия синдрома Цельвегера являются смертельными.

Осложнения
Синдром Цельвегера получил свое название по имени его первооткрывателя, американского педиатра. Заболевание имеет летальный исход в очень раннем возрасте. Самыми сложными осложнениями синдрома Цельвегера можно назвать задержку в психосоматическом развитии, нарушение роста, гипотонию мышц, развитие глаукомы и катаракты, долихоцефалию, различные поражения почек и печени, аномалии сердца, легких и половых органов. Все эти аномалии являются несовместимыми с жизнью.

Диагностика синдрома Цельвегера
Предположение на синдром Цельвегера можно поставить после обычного физического осмотра врачом. Но подтвердить серьезный диагноз можно только после проведения полноценного биохимического анализа. Стоит понимать, что биогенез пероксисом нарушается у больных на синдром Цельвегера из-за мутаций в одном из тринадцати известных генов (PEX). Именно они кодируют пероксисомы. Если хотя бы в одном из этих генов проявляется мутация, то это приводит к аномалии биогенеза пероксисом.

Анализы
Как уже говорилось выше, чтобы подтвердить страшное заболевание необходимо провести биохимический анализ. Если при анализе уровня жирных кислот с довольно длинной цепочкой обнаруживают нарушения в метаболизме пероксисомальной жирной кислоты и, при этом, существует ее повышенная концентрация в плазме, можно говорить о развитии синдрома Цельвегера. При этом количество плазмогенов (С18 и С16) в эритроцитных мембранах пониженное, а пинеколиновая кислота повышенная. Чтобы удостовериться в диагнозе иногда врач может порекомендовать пройти еще один анализ: последовательности тринадцати генов PEX.

Инструментальная диагностика
Чтобы обнаружить перисильвиарную полимикрогирию, а также некоторые другие пороки развития головного мозга при синдроме Цельвегера иногда используют МРТ (магнитно-резонансную томографию). Этот томографический метод позволяет без проблем исследовать внутренние органы и ткани с помощью ядерного магнитного резонанса. Благодаря такому методу можно увидеть, какие именно нарушения и аномалии была были развиты у пациента.
Какие анализы необходимы?
Дифференциальная диагностика
Среди самых популярных методов дифференциальной диагностики стоит выделить синдром Ушера 1 и 2, некоторые основные нарушения биогенеза пероксисом, поиск дефектов одного из ферментов в процессе бета-окисления жирной кислоты в пероксисомах.
Во время беременности, если врач заподозрит возможность развития у плода синдрома Цельвегера, можно провести пренатальное исследование амниоцитов, а также специальный анализ биопсии ворсин хориона на существование жирных кислот со слишком длинными цепочками. Также проводится анализ синтеза плазмелогена. Если оба анализа показали аллельные гены, которые могут вызвать синдром, стоит провести исследование ДНК с помощью пренатальной диагностики, а также диагностику генов (предимплантационную).
Так как синдром Цельвегера является заболеванием аутосомно-рецессивного типа, его можно диагностировать с помощью генетического консультирования.

К кому обратиться?
Лечение синдрома Цельвегера
К сожалению, лекарств от синдрома Цельвегера на сегодняшний день не существует. Можно использовать некоторые медицинские препараты, чтобы контролировать судороги. Как правило, для этой цели подходят обычные противоэпилептические средства:
Чтобы облегчить последствия печеночную печеночной коагулопатии, можно давать назначают витамин К, а при развитии холестаза в некоторых случаях можно использовать используют жирорастворимые витамины. Иногда необходимо устанавливать специальную гастростомическую трубку, чтобы заменить недостающие калории. Постарайтесь ограничить потребление тех продуктов, в составе которых есть большое количество фитановой кислоты (коровье молоко). Младенцам с тяжелым развитием гепатопатии необходимо давать холевую, желчную и хенодезоксихолевую кислоты. Это поможет снять болевые ощущения. Так как докозагексаеновая кислота не синтезируется организмом у больных на синдром Цельвегера, ее также необходимо доставлять штучным путем.
Синдром цельвегера что такое простыми словами
а) Группа I: заболевания с дефектом множества пероксисомных ферментов. Данная группа относится к ошибкам биогенеза пероксисом. Синдром Цельвегера, адренолейкодистрофия новорожденных и младенческая болезнь Рефсума относятся к данной группе. Заболевания характеризуются рядом клинических, биохимических и генетических аномалий, объединенных как характеристики Цельвегера. Четвертым заболеванием данной группы является точечная хондродисплазия тазобедренного сустава. Заболевание обладает характерным клиническим фенотипом и генетической причиной.
1. Цереброгепаторенаньный синдром Цельвегера (ЦЗ). Цереброгепаторенаньный синдром Цельвегера (ЦЗ), наиболее тяжелое заболевание I группы, проявляется у новорожденных детей типичным дисморфизмом лица, затрагивающим лоб, широко открытыми родничками и швами, тонкими выступами орбит, низкой и широкой переносицей, эпикантом, деформацией ушной раковины, микрогнатией и крыловидными складками шеи. Неврологические проявления представлены преимущественно тяжелой гипотонией, снижением или отсутствием сухожильных рефлексов и плохим сосанием и глотанием. Генерализованные припадки часто возникают в течение первых дней жизни.
Отсутствие психомоторного развития, плохое прибавление в весе и дегенерация сетчатки с угасанием электроретинографии являются постоянными проявлениями. Может выявляться атрофия зрительного нерва, катаракта или глаукома. Всегда отмечается гепатомегалия и дисфункция печени, часто встречается поликистоз почек. Точечная кальфицикация эпифизов может приводить к скелетным деформациям и контрактурам суставов. Часто отмечается биологическая недостаточность надпочечников. На ЭЭГ всегда имеются аномалии в виде многоочаговой пароксизмальной активности, а вызванные потенциалы существенно нарушены. Скорость проводимости нерва и показатели электронейромиографии в пределах нормы.
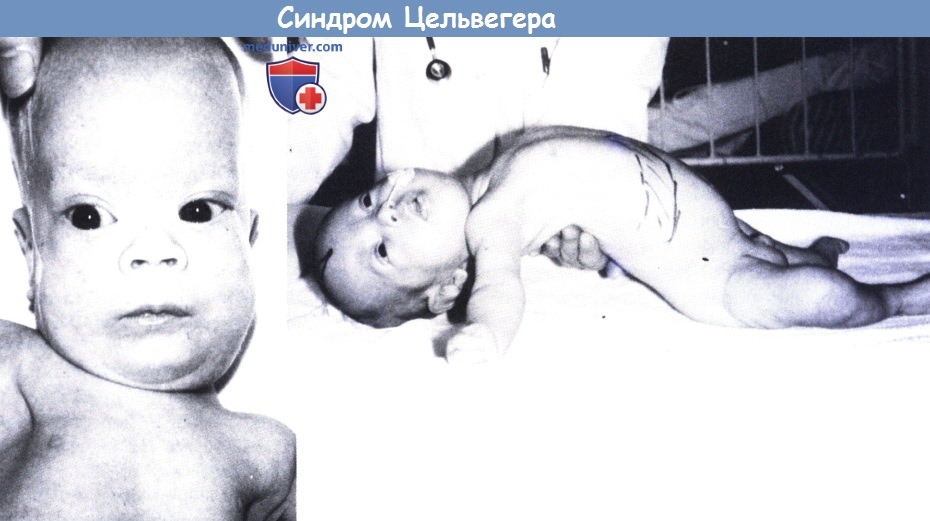
Слева: Отмечается высокий лоб, эпикант, косой разрез глаз.
Сверху: Заметная гипотония, гепатомегалия и затруднения глотания (назогастральный зонд).
2. Адренолейкодистрофия новорожденных (АЛДН) представляет собой заболевание менее тяжелой формы. Черепно-лицевой дисморфизм отсутствует или выражен слабо, у пациентов может отмечаться некоторый прогресс развития до начала деградации и последующей смерти, которая наступает в течение первого десятилетия жизни. Основные клинические проявления включают задержку развития или деградацию, гипотонию, припадки, нейросенсорную тугоухость и плохое зрение, обычно вследствие дегенерации сетчатки, иногда в сочетании с катарактой или атрофией зрительного нерва. Часто отмечается плохое прибавление в весе, как и субклиническая недостаточность коры надпочечников и дисфункция печени. На КТ и МРТ головного мозга можно выявить усиления контрастирования вокруг областей пониженной плотности белого вещества, данный феномен описан при сцепленной с Х-хромосомой адренолейкодистрофией.
Основными нейропатологическими изменениями являются демиелинизация (полушарий мозга, мозжечка и ствола мозга), нарушения миграции нейронов, менее стойкое и менее заметное, чем при синдроме Цельвегера (полимикрогирия и гетеротопии нейронов), периваскулярные лимфоцитарные инфильтраты и положительная ШИК-реакция макрофагов. При оценке ультраструктуры в данных макрофагах выявляется двухслойные включения, сходные с выявляемыми в других тканях, в частности, в коре надпочечников. У пациентов с АЛДН также отмечаются биохимические признаки множественной дисфункции пероксисом, напоминающие изменения при синдроме Цельвегера.
3. Младенческая болезнь Рефсума (МБР). Изначально заболевание описывалось как болезнь накопления фитановой кислоты, а в дальнейшем было установлено, что младенческая болезнь Рефсума (МБР) является наименее выраженной пероксисомной болезнью с отсутствием идентифицируемых пероксисом в печени. Клиническое течение характеризуется нормальным периодом новорожденности с последующими несколькими месяцами неспецифических проявлений с нарушениями пищеварения, напоминающими синдром мальабсорбции, гепатомегалией с нарушением функции печени, низким уровнем холестерина и аполипопротеинов в плазме и небольшим дисморфизмом лица. Задержка развития с гипотонией и атаксической походкой, хороидоретинопатия и нейросенсорная тугоухость становятся заметными к 1-3 годам. Пациенты могут дожить до второго десятилетия и страдают тяжелыми когнитивные расстройствами. Возможны легкие формы заболевания с нормальным интеллектуальным развитием (Poll-The et al., 2004a).
При нейровизуализации отмечается умеренная атрофия без признаков мальформации коры или участков эхонегативной зоны. При патологоанатомическом исследовании в одном случае были выявлены микронодулярный цирроз печени, гипоплазия надпочечников, отсутствие макроскопических мальформаций головного мозга, но при этом имелась выраженная гипоплазия гранулярного слоя мозжечка с эктопией клеток Пуркинье в молекулярном слое (Moser, 1989). Печеночные пероксисомы морфологически отсутствуют, и у пациентов отмечается множественная дисфункция пероксисом.
Синдром Цельвегера, адренолейкодистрофия новорожденных и младенческая болезнь Рефсума представляют фенотипические варианты мутаций гена РЕХ. Есть описания и многих других вариантов, но они плохо поддаются классификации. Тем не менее, вариабельная задержка развития, болезни печени, ретинопатия, нейросенсорная тугоухость и дебют заболевания в раннем детском возрасте являются основными признаками. Клиническое течение так же вариабельно, и вне зависимости от формы в большом проценте случаев отмечается длительная выживаемость с разной степенью инвалидизации (Poll-The et al., 2004а).
4. Точечная хондродисплазия тазобедренного сустава. Точечная хондродисплазия тазобедренного сустава 1 типа характеризуется микросомией в основном за счет бедренных костей, дисморфизмом лица, катарактой, задержкой умственного развития и спастичностью. Точечная эпифизарная и экстра-эпифизарная кальцификация отмечается в младенческом возрасте и может исчезать после двух лет с формированием скелетных деформаций. У некоторых пациентов отмечается гепатомегалия и ихтиоз. Заболевание характеризуется заметной клинической гетерогенностью и наличием вариантных форм с отсутствием укорочения бедра и слабо выраженной задержкой развития при типичных биохимических аномалиях. При тяжелой форме заболевания на МРТ мозга видна отсрочка демиелинизации и аномалии сигнала в супратенториальном белом веществе, прогрессирующая атрофия мозга и мозжечка. При легкой форме заболевания МРТ в пределах нормы (Bams-Mengerink et al., 2006). Данное обстоятельство является следствием мутаций гена РЕХ7, блокирующего импорт белка PTS2. Дефицит плазмалогенов в эритроцитах является наиболее достоверным маркером, обычно он сочетается с повышением уровня фитановой кислоты в плазме.
Данные нарушения биогенеза пероксисом сочетаются с генерализованной или множественной утратой функций пероксисом. Повышение уровня сверхдлинноцепочечных жирных кислот в плазме, в частности С26:0 (гексазановой кислоты), является наиболее достоверным диагностическим тестом при синдроме Цельвегера, адренолейкодистрофии новорожденных и младенческой болезни Рефсума. Данные результаты подтвердились в ходе исследований на культурах фибробластов с тяжелым нарушением окисления сверхдлинноцепочечных жирных кислот. Повышение уровня промежуточных желчных кислот (тригидрохолестановой и дигид-рохолестановой кислот) вызвано дефектом бета-окисления желчных кислот. Повышение уровня фитановой и пристановой кислот связано с нарушением альфа- и бета-окисления. Тем не менее, накопление фитановой кислоты в плазме менее отчетливо, чем при болезни Рефсума взрослых. Высокое содержание пипеколата в плазме и спинномозговой жидкости отмечается практически у всех пациентов.
Снижение содержания плазмалогена в эритроцитах и культуре фибробластов, дефект действия дигидроксиацетон-фосфат-ацилтрансферазы в фибробластах, лейкоцитах или тромбоцитах являются основными проявлениями данного заболевания. С другой стороны, биохимические аномалии при точечной хондродисплазии тазобедренного сустава включают низкое содержание плазмалогенов в эритроцитах в связи с нарушением биосинтеза, аккумуляцию фитановой кислоты и нормальный уровень сверхдлинноцепочечных жирных кислот в плазме.
б) Группа II: Заболевания с дефектом одного пероксисомного фермента:
1. Сцепленная с Х-хромосомой адренолейкодистрофия. Х-АЛД (Moser HW et al., 1995) является относительно частым заболеванием, проявления которого сочетают поражение центральной нервной системы и надпочечников. Нарушение работы надпочечников клинически проявляется только в редких случаях. Более чем у половины пациентов заболевание проявляется в детском возрасте, приблизительно у 25% симптомы манифестируют поздно в виде адреномиелонейропатии, а у 10% пациентов выявляется изолированная болезнь Адиссона. По результатам некоторых исследований адреномиелопатия являлась наиболее частым фенотипом (van Geel et al., 1997). Одним из заметных проявлений Х-АЛД является интенсивность воспалительных реакций центральной нервной системы. Причина не ясна, вероятно, имеется связь с наличием аномальных липидов. Данная реакция может играть важную роль в патогенезе заболевания и отсутствует у пациентов с адреномиелонейропатией. Данное заболевание описано в главе 9 вместе с другими лейкодистрофиями.
2. Другие изолированные дефекты пероксисомного бета-окисления. Несколько случаев, напоминающих адренолейкодистрофию новорожденных или синдром Цельвегера, были описаны при изолированном дефиците одного из специфических ферментов системы пероксисомного бета-окисления. Дефицит ацил-кофермент-А-оксидазы I был описан у небольшого количества пациентов с признаками, напоминающими адренолейкодистрофию новорожденных. Дефект В-бифункционального белка является причиной тяжелой энцефалопатии новорожденных, дисморфии и аномальной миграции нейронов, напоминающей синдром Цельвегера. Большая часть пациентов умерла в течение первых двух лет жизни, в небольшом количестве случаев отмечалась большая продолжительность жизни в сочетании с тяжелыми когнитивными нарушениями, нарушениями зрения и слуха и периферической нейропатией (Ferdinandusse et al., 2006). Независимо от локализации дефекта отмечалось повышение уровня сверхдлинноцепочечных жирных кислот в плазме, в то время как другие функции пероксисом оставались нормальными.
При последних двух заболеваниях одновременно с увеличением количества сверхдлинноцепочечных жирных кислот отмечалось накопление тригидрохолестановой и дигидрохолестановой кислот. При заболеваниях данной группы достаточно ограниченный биохимический дефект приводит к полиорганному поражению, аналогичному изменениям при нарушениях биогенеза пероксисом, что предполагает возможность глубоких нарушений развития вследствие дефекта системы пероксисомного бета-окисления. Кроме того, дефицит 2-метилацил-кофермент-А-рацемозы был обнаружен у двух взрослых пациентов с начавшейся во взрослом возрасте невропатией, с проявлениями как при Х-АЛД и болезни Рефсума взрослых. Биохимические изменения включают накопление 2-метил разветвленных цепей жирных кислот, тригидрохолестановой и дигидрохолестановой кислот.
3. Изолированные дефекты пероксисомных ферментов, не затрагивающие бета-окисление. Классическая болезнь Рефсума характеризуется накоплением фитановой кислоты в тканях и жидкостях организма вследствие нарушения окисления фитанов. Другие функции пероксисом не изменяются. Для окончательного диагноза необходимо определение функции ферментов и оценка мутаций, так как у ряда пациентов с нормальной активностью фитаноилоксидазы отмечаются мутации гена РЕХ7 (Wills et al., 2001; van den Brink et al., 2003).
Два типа точечной хондродисплазии тазобедренного сустава связаны с изолированным дефицитом дигидроксиацетон-фосфат-ацилтрансферазы (точечная хондродисплазия тазобедренного сустава 2 типа) или алкил-дигидроацетон-фосфат-синтазы (точечная хондродисплазия тазобедренного сустава 3 типа). При тяжелых формах заболевания у пациентов формируется клинический фенотип, сходный с «классическим» синдромом точечной хондродисплазии тазобедренного сустава. Это подтверждает потенциальную патофизиологическую роль плазмалогенов в формировании аномалий центральной нервной системы. Также описаны некоторые более легкие формы заболевания с частичным проявлением клинических признаков, в частности, в виде легкой дисморфии и легкого нарушения неврологических функций (Bams-Mengerink et al., 2006).
в) Лечение пероксисомных болезней. При классической болезни Рефсума ограничение потребления продуктов, содержащих фитановую кислоту, в сочетании с плазмаферезом или без него может предотвратить дальнейшее прогрессирование заболевания (Wills et al., 2001). Возможности лечения пациентов с нарушениями биогенеза пероксисом ограничены, так как тяжелые аномалии формируются внутриутробно, а специфическая терапия в настоящее время отсутствует. Дополнительное введение докозагексаеновой кислоты может улучшать состояние пациентов с легкими или атипичными формами дефектов биогенеза пероксисом или изолированными дефектами бета-окисления (Martinez, 1996; Martinez и Vazquez, 1998).
При Х-АЛД диетическое лечение смесью глицериновых эфиров олеиновой и эруковой кислот (масло Лоренцо) эффективно для нормализации уровня сверхдлинноцепочечных жирных кислот (Korenke et al., 1995). Тем не менее, клиническая эффективность диет не определена, они не предотвращают ухудшение состояния, хотя имеются некоторые противоположные предположения. Возможность предотвращения деградации у мальчиков, которым лечение проводилось на бессимптомной стадии, объясняет отдельные положительные результаты (Aubourg et al., 1993). Трансплантация костного мозга в отдельных случаях приводила к ярко выраженным результатам (Aubourg et al., 1990), а улучшение отмечалось у 7 из 52 мальчиков, которым проводилось лечение. В отсутствие подходящего донора смертность была высокой.
Такое лечение может быть показано в отсутствие клинических симптомов при выявлении на МРТ ранних аномалий внутренней капсулы или мозолистого тела (Aubourg et al., 1992; Moser H. W. et al., 1995). В настоящее время предпринимаются попытки другого подхода в лечении с использованием противовоспалительных препаратов (бета-интерферона и талидомида) для подавления интенсивности воспалительной реакции как возможной причины некоторых клинических проявлений данного заболевания.
Редактор: Искандер Милевски. Дата публикации: 12.12.2018