Синдром мовата вильсона у детей что это
Моуат-Вильсон синдром
OMIM 235730
Наша команда профессионалов ответит на ваши вопросы
Синдром Моуат-Вильсона – аутосомно-доминантное заболевание, впервые описано в 1998 году. Клинические характеристики: умственная отсталость, микроцефалия, эпилепсия, низкий рост, врожденные сердечные нарушения, отсроченное моторное развитие. Для больных характерен типичный лицевой фенотип: гипертелоризм (увеличенное расстояние между внутренними краями глазниц), сходящееся косоглазие, широкая носовая перегородка, закругленный кончик носа, постоянно открытый рот, выступающий заостренный подбородок, повернутая назад ушная раковина. При магнитно-резонансном исследовании головного мозга часто обнаруживается гипоплазия или агенезия мозолистого тела (corpus callosum).
В 41-71% случаев у пациентов с синдромом Моуат-Вильсона обнаруживаются признаки болезни Гиршпрунга: отсутствие отхождения мекония в течение первых 24-48 часов жизни, метеоризм, увеличение окружности живота, боли в животе, стойкие запоры, рвота. Как правило, участок аганглиоза у данных больных небольшой. Синдром Моуат-Вильсона, наряду с другими заболеваниями, является несиндромальной формой болезни Гиршпрунга.
В 2001 году описан ген ZEB2 (ZFHX1B, SMADIP1), ответственный за развитие синдрома Моуат-Вильсона. Мутации в гене происходят de novo, как правило, это нонсенс мутации (приводящие к появлению преждевременного стоп-кодона) и мутации со сдвигом рамки считывания. Часто у больных обнаруживаются крупные делеции (от 0.2 до 10.4 млн.пар нуклеотидов) в области 2q22-q24.1, полностью или частично затрагивающие ген ZEB2.
В Центре Молекулярной генетики проводится поиск мутаций в гене ZEB2 методом автоматического секвенирования, а также цитогенетическое исследование для поиска крупных делеций.
Болезнь Вильсона у детей. Клинические рекомендации.
Болезнь Вильсона у детей
Оглавление
Ключевые слова
Список сокращений
БВ – болезнь Вильсона
МНО – международное нормализованное отношение
ОТП – ортотопическая трансплантация печени
ПИ – протромбиновый индекс
УЗИ – ультразвуковое исследование
ЩФ – щелочная фосфатаза
МРТ – магнитно-регонансная томография
КТ – компьютерная томография
Термины и определения
Хелатная терапия – способ лечения, заключающийся во введении препаратов, связывающих и выводящих из организма ионы тяжелых металлов.
Гепатомегалия – увеличение печени.
Спленомегалия – увеличение селезенки.
Стеатоз печени – наиболее распространенный гепатоз, при котором в печёночных клетках происходит накопление жира.
Фиброз печени – разрастание соединительной ткани органа, возникающее при чрезмерном накоплении белков внеклеточного матрикса (основы соединительной ткани).
Цирроз печени – хроническое заболевание печени, сопровождающееся необратимым замещением паренхиматозной ткани печени фиброзной соединительной тканью, или стромой.
1. Краткая информация
1.1 Определение
Болезнь Вильсона (БВ) относится к числу наиболее трудно диагностируемых заболеваний печени в связи с длительным латентным течением, особенно на начальных стадиях заболевания, и большим полиморфизмом клинической симптоматики. В связи с этим болезнь Вильсона необходимо исключать у каждого пациента детского и подросткового возраста с патологией печени неуточненной этиологии.
Своевременное назначение патогенетической терапии при болезни Вильсона у детей сопровождается регрессом клинической симптоматики, предотвращением формирования цирроза печени и неврологической симптоматики, улучшением качества жизни и социальной адаптации ребенка. В связи с этим важнейшей медицинской и социальной задачей является ранняя диагностика и адекватная терапия БВ 7.
Болезнь Вильсона (синонимы: болезнь Вильсона-Коновалова, гепатолентикулярная дегенерация, гепатоцеребральная дистрофия) – редкое наследственное заболевание, связанное с нарушением метаболизма меди и избыточным ее накоплением в различных органах и тканях, преимущественно проявляющееся симптоматикой поражения печени и центральной нервной системы 2.
1.2 Этиология и патогенез
ATP7B – ген экспрессируется, в основном, в печени и кодирует медьтранспортирующую АТФ-азу (АТФ-аза 7В, АТФ-аза 2, АТФ-аза Р-типа). Генетически детерминируемое снижение функции медь-транспортирующей АТФ-азы в результате молекулярных дефектов в гене АТР7В приводит к снижению гепатобилиарной экскреции меди и нарушению встраивания меди в церулоплазмин, в результате экскретируется и циркулирует апоцерулоплазмин (ненагруженный медью, срок полувыведения которого сокращается вдвое, что и объясняет гипоцерулоплазминемию), а медь накапливается в различных органах и тканях, преимущественно в печени, головном мозге, роговице глаза, почках, обеспечивая полиморфизм клинических появлений БВ. Вся циркулирующая (в сыворотке крови) медь связана церулоплазмином, а парадокс БВ, при которой отмечается низкий уровень меди в сыворотке крови при перегрузке тканей, объясняется низким уровнем церулоплазмина. При тяжелых формах БВ, протекающих с цитолизом, повышение концентрации меди до нормы и выше связано с распадом перегруженных медью гепатоцитов, свободная (не связанная церулоплазмином) медь крайне токсична и провоцирует гемолитические кризы 2.
В организм медь поступает в основном с пищей (табл.1). Наиболее богаты медью следующие продукты: печень, моллюски, крабы, креветки, устрицы, лобстеры, соевые бобы, шоколад, орехи.
Синдром Вильсона-Микити
Синдром Вильсона-Микити – редкое интерстициальное заболевание легких, которое дебютирует в период новорожденности и сопровождается развитием поздней кислородозависимости. Проявляется выраженной одышкой и диффузным цианозом, частыми приступами апноэ. Характерно отсутствие признаков интоксикации и инфекционно-воспалительных изменений, в том числе лабораторных. Диагностика основана на совокупности клинических сведений и рентгенологической картины, имеющей патогномоничные признаки синдрома Вильсона-Микити. Лечение заболевания симптоматическое, специфическая терапия не разработана.
МКБ-10
Общие сведения
Синдром Вильсона-Микити – криптогенное поражение интерстициальной ткани легких новорожденных. Впервые о данной патологии педиатры заговорили в 1960 году. Чуть позже заболевание стали считать новой формой бронхолегочной дисплазии, но на сегодняшний день доказана разная природа этих нозологий. Синдром Вильсона-Микити чаще встречается среди недоношенных детей, особенно если гестационный возраст составляет менее 32 недель. Встречается редко, распространенность – менее 1 случая на 10 000 новорожденных. Тем не менее, доля патологии составляет около 4% среди всех хронических заболеваний легких новорожденных, летальность – примерно 10%.
В последние годы синдром Вильсона-Микити диагностируется реже, чем 10-20 лет назад, но уровень смертности сохраняется, а само заболевание все чаще протекает с атипичной клинической картиной. Кроме того, возрастает процент сочетанных патологий, что неизбежно приводит к росту количества летальных исходов и случаев тяжелого течения. Заболевание далеко не всегда становится причиной детской инвалидности, однако ребенку нередко в течение долгих лет требуются особые условия обучения в связи с необходимостью периодической кислородной поддержки и слаборазвитым легочным иммунитетом. Очевидна высокая актуальность проблемы в педиатрии.
Причины синдрома Вильсона-Микити
Этиология заболевания в настоящее время неизвестна. Доказано влияние малого веса при рождении, особенно в случае недоношенности, гораздо реже речь идет о низком весе при нормальном гестационном возрасте. Предполагается связь синдрома Вильсона-Микити с внутриутробным инфицированием, однако эти сведения нельзя считать достоверными, поскольку не всегда определяется четкая корреляция. У матерей заболевших детей часто имеются в анамнезе различные патологии беременности и родов: преждевременная отслойка плаценты, краевое и центральное предлежание плаценты, хориоамнионит, затяжные роды и др.
Основную роль в патогенезе синдрома Вильсона-Микити играет развитие специфического воспаления интерстициальной ткани в бронхолегочной системе. При этом отсутствует связь с конкретным инфекционным агентом, типичные признаки воспалительного процесса также не выявляются. По ходу течения заболевания отек интерстиция сменяется его фиброзной деформацией, которая всегда обнаруживается в области мелких бронхов и периваскулярно. Следствием является значительное снижение эффективной дыхательной поверхности, что приводит к типичной клинической картине синдрома Вильсона-Микити.
Симптомы и диагностика синдрома Вильсона-Микити
Признаки заболевания чаще всего обнаруживаются на 5-35 день жизни. До появления первых симптомов нарушения со стороны легких, как правило, отсутствуют. Синдром Вильсона-Микити начинается с учащения дыхания и диффузного цианоза, усиливающегося при нагрузках, например, во время кормления. Патогномоничным признаком заболевания являются частые приступы отсутствия дыхания – апноэ, сопровождающиеся выраженной брадикардией. Достаточно быстро развивается кислородозависимость. Температура остается нормальной за исключением редких случаев присоединения вторичной бактериальной инфекции.
Диагноз ставится педиатром на основании клинической картины в сочетании с характерными рентгенологическими изменениями. Обращают на себя внимание недоношенность и низкий вес ребенка, частое присутствие патологий беременности и родов в анамнезе матери. Легочная недостаточность при синдроме Вильсона-Микити не связана с инфекциями и воспалительными процессами, которые исключаются при помощи лабораторной диагностики. Признаки воспаления в анализах крови отсутствуют. Не подтверждается и инфекционная природа заболевания, хотя в некоторых случаях внутриутробные инфекции протекают параллельно с данным синдромом.
Синдром Вильсона-Микити имеет характерные рентгенологические признаки, которые меняются по мере развития патологии. Сначала обнаруживается повышенная аэрация легких. Затем появляются фиброзные полосы, расположенные вдоль бронхов и чаще уходящие в верхние доли легких. В течение нескольких месяцев и даже лет происходит постепенная нормализация рентгенологический картины. Интересен тот факт, что изменения на снимках могут возникать раньше первых клинических признаков синдрома Вильсона-Микити, а после клинического выздоровления рентгенологическая картина еще долгое время приходит в норму.
Лечение и прогноз при синдроме Вильсона-Микити
Специфическая терапия не разработана, проводится симптоматическое лечение. Всегда назначается кислородотерапия. Это может быть кислородная маска, но часто требуется ИВЛ. Оксигенотерапия является временной мерой, после улучшения состояния ребенка она отменяется. Также необходима коррекция легочной гипертензии и сопутствующей застойной сердечной недостаточности. С этой целью в лечении синдрома Вильсона-Микити могут использоваться сердечные гликозиды. Антибиотикотерапия показана исключительно при инфекционных осложнениях, в остальных случаях применение антибиотиков не оправдано. Состояние ребенка постепенно улучшается в течение одной-двух недель.
Прогноз заболевания сомнительный. Синдром Вильсона-Микити остается заболеванием с невыясненной этиологией, что создает определенные трудности в терапии. Кроме того, невозможно предсказать развитие патологии. Летальность сохраняется на уровне 10%, связана с септическими осложнениями, тяжелой степенью дыхательной и сердечной недостаточности. Помимо этого, выраженная продолжительная гипоксия негативно влияет на дальнейшее нервно-психическое здоровье ребенка, становясь причиной задержки психического развития. Профилактика не разработана, снизить риск развития синдрома Вильсона-Микити может только грамотное ведение и сохранение беременности.
Болезнь Вильсона — наследственное заболевание, передающееся по аутосомно-рецессивному типу. Возникает в условиях мутаций в гене АТР7В, кодирующем белок медьтраснпортирующей АТФазы печени. Характерный признак болезни Вильсона — накопление меди в различных органах и тканях, в большей степени в печени и базальных ганглиях. Болезнь Вильсона может протекать в брюшной, ригидно-аритмогиперкинетической, дрожательной или экстрапирамидно-корковой форме. Диагностика болезни Вильсона включает офтальмологическое обследование, биохимические анализы мочи и крови, МРТ или КТ головного мозга. Основу патогенетической терапии составляют тиоловые препараты, которые могут приниматься в течении нескольких лет и даже пожизненно.
МКБ-10
Общие сведения
Болезнь Вильсона — наследственное заболевание, передающееся по аутосомно-рецессивному типу. Возникает в условиях мутаций в гене АТР7В, кодирующем белок медьтраснпортирующей АТФ-азы печени. Характерный признак болезни Вильсона — накопление меди в различных органах и тканях, в большей степени в печени и базальных ганглиях. Первооткрыватель заболевания — А.К. Вильсон, описавший заболевание в 1912 году, в отечественной медицине — Н.А. Коновалов. Патогенез болезни Вильсона был выявлен в 1993 году. Понятию «болезнь Вильсона» соответствуют также: болезнь Вильсона-Коновалова, болезнь Вестфаля-Вильсона-Коновалова, дистрофия гепатоцеребральная, дистрофия гепатолентикулярная, дегенерация лентикулярная прогрессирующая.
Причины
Ген АТР7В картирован на длинном плече хромосомы 13 (13q14.3-q21.1). Организм человека содержит около 50-100 мг меди. Суточная потребность меди для человека — 1-2 мг. 95% абсорбированной в кишечнике меди, транспортируется в форме комплекса с церулоплазмином (один из глобулинов сыворотки, синтезируемых печенью) и только 5% в форме комплекса с альбумином. Кроме того, ион меди входит в состав важнейших метаболических ферментов (лизилоксидаза, супероксиддисмутаза, цитохром-С-оксидаза и др.). При болезни Вильсона происходит нарушение двух процессов обмена меди в печени — биосинтез главного медьсвязывающего белка (церулоплазмина) и выведение меди с желчью, следствием чего становится повышение уровня несвязанной меди в крови. Концентрация меди в различных органах (чаще всего в печени, почках, роговице и головном мозге) увеличивается, что приводит к их токсическому поражению.
Классификация
Согласно классификации Н.В. Коновалова различают пять форм болезни Вильсона:
Симптомы
Для болезни Вильсона характерен клинический полиморфизм. Первые проявления заболевания могут появиться в детстве, юношестве, в зрелом возрасте и гораздо реже в зрелом возрасте. В 40-50% случаев Болезнь Вильсона манифестирует с поражения печени, в остальных — с психических и неврологических расстройств. С вовлечением в патологический процесс нервной системы обнаруживается кольцо Кайзера-Флейшера.
Брюшная форма развивается преимущественно до 40 лет. Характерный признак — тяжелое поражение печени по типу цирроза печени, хронического гепатита, фульминантного гепатита.
Ригидно-аритмогиперкинетическая форма манифестирует в детском возрасте. Начальные проявления — мышечная ригидность, амимия, смазанность речи, трудности при выполнении мелких движений, умеренное снижение интеллекта. Для этой формы заболевания характерно прогрессирующее течение, с наличием эпизодов обострения и ремиссии.
Дрожательная форма возникает в возрасте от 10 до 30 лет. Преобладающим симптомом является тремор. Кроме того, могут наблюдаться брадикинезия, брадилалия, тяжелый психоорганический синдром, эпилептические приступы.
Экстрапирамидно-корковая форма встречается весьма редко. Ее начало схоже с началом какой-либо из вышеперечисленных форм. Для нее характерны эпилептические припадки, экстрапирамидные и пирамидные нарушения и выраженный интеллектуальный дефицит.
Диагностика
Офтальмологическое исследование с помощью щелевой лампы выявляет кольцо Кайзера-Флейшера. Биохимические исследования мочи обнаруживают повышенную экскрецию меди в суточной моче, а также снижение концентрации церулоплазмина в крови. С помощью визуализационных методов (КТ и МРТ головного мозга) обнаруживают атрофию полушарий большого мозга и мозжечка, а также базальных ядер.
При диагностике болезни Вильсона неврологу необходимо дифференцировать ее от паркинсонизма, гепатоцеребрального синдрома, болезни Геллервордена-Шпатца. Основным дифференциально-диагностическим признаком этих заболеваний является отсутствие характерных для болезни Вильсона кольца Кайзера-Флейшера и расстройств обмена меди. Для подтверждения болезни Вильсона проводится генодиагностика.
Лечение болезни Вильсона
Основой патогенетического лечения является назначение тиоловых препаратов, в первую очередь — D-пеницилламина либо унитиола. Главное преимущество купренила — низкая токсичность и возможность длительного приема при отсутствии побочных эффектов. Его назначают по 0,15 г (1 капсула) в сутки (только после еды), в дальнейшем, в течение 2,5-3 месяцев дозу увеличивают до 6-10 капсул/сутки (оптимальная доза). Лечение D-пеницилламином проводится годами и даже пожизненно с небольшими перерывами (на 2-3 недели) в случае появления побочных эффектов (тромбоцитопения, лейкопения, обострения язвенной болезни желудка и т. д.).
Унитиол назначают в случае непереносимости (плохой переносимости) D-пеницилламина. Длительность одного курса лечения — 1 месяц, после чего лечение приостанавливают на 2,5-3 месяца. В большинстве случаев наступает улучшение общего состояния пациента, а также регресс неврологических симптомов (скованности, гиперкинезов). В случае доминирования гиперкинезов рекомендовано назначение небольших курсов нейролептиков, при ригидности — леводопы, карбидопы, тригексифенидила.
В случае тяжелого течения болезни Вильсона, при неэффективности консервативного лечения за рубежом прибегают к трансплантации печени. При положительном исходе операции состояние пациента улучшается, восстанавливается обмен меди в организме. В дальнейшем лечение пациента составляет иммуносупрессивная терапия. В России на сегодня постепенно внедряется в клиническую практику метод биогемоперфузии с изолированными живыми клетками селезенки и печени (т. н. аппарат «вспомогательная печень). Немедикаментозное лечение состоит в назначении диеты (стол №5) в целях исключения продуктов богатых медью (кофе, шоколад, бобовые, орехи и т. д.).
Прогноз и профилактика
В случае своевременного диагностирования болезни Вильсона и проведения адекватной медьснижающей терапии возможна нормализация общего состояние пациента и обмена меди в организме. Постоянный прием тиоловых препаратов по схеме, назначенной врачом-специалистом, позволяет поддерживать профессиональную и социальную активность пациента.
Для предотвращения рецидивов болезни Вильсона рекомендовано проведение лабораторных исследований крови и мочи пациента несколько раз в год. Необходим контроль следующих показателей: концентрация меди, церулоплазмина и цинка. Кроме того, рекомендовано проведение биохимического анализа крови, общего анализа крови, а также регулярные консультации у терапевта и невролога.
Болезнь Вильсона у детей
Болезнь Вильсона относится к числу наиболее трудно диагностируемых заболеваний печени в связи с длительным латентным течением, особенно на начальных стадиях заболевания, и большим полиморфизмом клинической симптоматики. В связи с этим болезнь Вильсона необходимо исключать у каждого пациента детского и подросткового возраста с патологией печени неуточненной этиологии. Своевременное назначение патогенетической терапии при болезни Вильсона у детей сопровождается регрессом клинической симптоматики, предотвращением формирования цирроза печени и неврологической симптоматики, улучшением качества жизни и социальной адаптации ребенка. В связи с этим важнейшей медицинской и социальной задачей является ранняя диагностика и адекватная терапия болезни Вильсона. Данный протокол по диагностике и терапии болезни Вильсона у детей создан на основании систематического обзора литературы 1996-2013 годов Medline (Pubmed version), Embase (Dialog version) и Cochrane Library databases, с использованием созданных протоколов диагностики и терапии болезни Вильсона: Guideline AASLD 2008 (American Association for the Study of Liver Diseases) и Guideline EASL 2011 (European Association for the Study of the Liver).
Болезнь Вильсона относится к редким заболеваниям, что исключает возможность проведения больших когортных и рандомизированных контролированных исследований и для создания протоколов диагностики и терапии используются лишь тематические исследования экспертов, опубликованные в последние десятилетия.
Определение
Болезнь Вильсона – редкое наследственное заболевание, связанное с нарушением метаболизма меди и избыточным ее накоплением в различных органах и тканях, преимущественно проявляющееся симптоматикой поражения печени и центральной нервной системы.
Код по МКБ10:
Е 83.0 Нарушение обмена меди;
Генетические аспекты и эпидемиология болезни Вильсона
Патологический ген, ответственный за развитие болезни Вильсона – ген АТР7В, локализован на длинном плече 13 хромосомы (13q14.3-q21.1), состоит из 21 экзона и примерно 7,5 тысяч гетероциклических оснований нуклеиновой кислоты. Тип наследования заболевания аутосомно-рецессивный. В настоящее время известно около 500 мутаций гена АТР7В, из которых 380 идентифицированы в патогенезе заболевания.
Частота встречаемости болезни Вильсона в популяции колеблется от 1:30000 до 1:100000, с частотой гетерозиготного носительства патологического гена 1:90. Наиболее распространенной мутацией в гене АТР7В среди европеоидной расы является мутация 3207C>A (H1069Q) в экзоне 14. Около 50-80% пациентов с болезнью Вильсона, проживающих в странах Центральной, Восточной и Северной Европы являются носителями по крайней мере одной аллели с данной мутацией. Среди европейского населения встречаются также мутации в экзоне 8 (2299insC, G710S), в экзоне 15 (3402delC), в экзоне 13 (R969Q). Однако, частота встречаемости данных мутаций составляет менее 10%. Частота встречаемости мутации Н1069Q в российской популяции составляет 30,5%, мутации 3402delC – 2,2%. В Бразилии в 30% случаев БВ определяется мутация 3402delC, среди монглоидной расы – мутация 2333G>T (R778L) в 8 экзоне, идентифицируемая с частотой 12-45,6% в зависимости от территориального ареала проживания. Заболевание проявляется при гомозиготном или компаунд-гетерозиготном носительстве мутаций гена АТР7В.
Патогенез болезни Вильсона
ATP7B – ген экспрессируется, в основном, в печени и кодирует медьтранспортирующую АТФ-азу (АТФ-аза 7В, АТФ-аза 2, АТФ-аза Р-типа). Генетически детерминируемое снижение функции медь-транспортирующей АТФ-азы в результате молекулярных дефектов в гене АТР7В приводит к снижению гепатобилиарной экскреции меди и нарушению встраивания меди в церулоплазмин, вследствие чего медь накапливается в различных органах и тканях, преимущественно в печени, головном мозге, роговице глаза, почках, обеспечивая полиморфизм клинических появлений болезни Вильсона.
В организм медь поступает в основном с пищей. Наиболее богаты медью следующие продукты: печень, моллюски, крабы, креветки, устрицы, лобстеры, соевые бобы, шоколад, орехи. Суточная потребность – 2-4 мг меди в сутки. Верхний допустимый уровень потребления меди – 5 мг (Данные Госсанэпиднадзора России). Дефицит меди в организме может развиваться при недостаточном поступлении этого элемента (1 мг/сутки и менее), а порог токсичности для человека равен 200 мг/суткиРазличные мутации могут влиять на разные функции АТР-азы 7В в разной степени, поэтому, можно предположить, что при некоторых мутациях нарушается экскреция меди в желчь, но при этом встраивание меди в церулоплазмин и его экскреция в кровь не изменяется.
Патогенные эффекты избытка меди в клетке опосредованы генерацией свободных радикалов, которые истощают клеточные запасы глютатиона и токоферола, окисляют липиды, ферменты и белки цитоскелета. Вследствие повышения внутриклеточной концентрации меди повреждается множество внутриклеточных систем, хотя точная клеточная мишень, на которую воздействует избыток меди, неизвестна. На ранних стадиях печеночно-клеточного повреждения вовлечение в процесс эндоплазматического ретикулума, митохондрий, пероксисом и ядрышек в сочетании со снижением активности митохондриальных ферментов ведет к перекисному окислению липидов, накоплению триглицеридов, а далее – к некрозу гепатоцитов. Образующийся в результате перекисного окисления липидов малоновый диальдегид стимулирует синтез коллагена, способствуя фиброгенезу. Лизис перегруженных медью гепатоцитов приводит к повышению уровня свободной меди в сыворотке крови и, следовательно, компенсаторному повышению суточной экскреции ее с мочой и накоплению в органах-мишенях.
Клиническая картина болезни Вильсона
Клиническая картина болезни Вильсона характеризуется многообразием симптомов и редко манифестирует до 5-летнего возраста. Однако, описаны случаи дебюта болезни Вильсона у ребенка до достижения 2-х лет, цирроза печени в исходе болезни Вильсона у 3-х летнего ребенка и развитие острой печеночной недостаточности у ребенка 5 лет.
Развернутая клиническая симптоматика болезни Вильсона характеризуется значительным разнообразием, обусловленным избыточным накоплением меди в различных органах и тканях и преимущественно проявляется симптомами поражения печени, центральной нервной системы, глаз, реже почек, костей, сердца, желез внутренней секреции. Неврологическая симптоматика болезни Вильсона манифестирует позже, чем поражение печени, в большинстве случаев на втором – третьем десятилетии жизни, но может проявляться и в детском возрасте с частотой до 26%. Наиболее ранний возраст дебюта неврологической симптоматики болезни Вильсона описан у ребенка 4 лет, печеночной – у ребенка 2 лет.
Поражение печени при болезни Вильсона
Симптомы поражения печени при болезни Вильсона у детей весьма вариабельны и имеют тенденцию к более ранней манифестации, чем неврологическая симптоматика. Первичная манифестация болезни Вильсона может протекать в виде острого фульминантного гепатита, проявляющегося коагулопатией, энцефалопатией, Кумбс-негативной гемолитической анемией, печеночноклеточной и почечной недостаточностью, с выявлением значительного превышения меди в сыворотке крови и моче.
Клиническая картина хронического гепатита при болезни Вильсона мало отличима от поражения печени другого генеза и без патогенетической терапии приводит к формированию цирроза печени, что диктует необходимость исключения болезни Вильсона у всех пациентов с хроническим поражением печеночной паренхимы с или без цирроза печени. Характерной чертой хронического гепатита при болезни Вильсона является умеренное повышение биохимических маркеров цитолиза, холестаза и билирубинового обмена с высоким уровнем структурных изменений печеночной паренхимы при морфологическом исследовании биоптатов печени. Болезнь Вильсона может клинически протекать по типу аутоиммунного гепатита, с выявлением повышенного уровня сывороточных иммуноглобулинов и неспецифических аутоантител, следовательно, необходимо исключать болезнь Вильсона и у больных с аутоиммунным гепатитом при неэффективности кортикостероидной терапии.
Поражение печени при болезни Вильсона у детей при отсутствии патогенетической терапии характеризуется высокой частотой (44%) формирования цирротической трансформации печени в пубертатном периоде. При отсутствии цирроза печени отмечено преобладание симптомов хронического гепатита минимальной и умеренной степени активности.
Морфологические изменения печени при болезни Вильсона не являются патогномоничными и включают в себя на ранних стадиях признаки жировой инфильтрации гепатоцитов (крупнокапельной и мелкокапельной), гликогеновой дегенерации ядер и фокальный гепатоцеллюлярный некроз, а также преобладание минимальной и низкой степени активности воспалительного процесса в сочетании с высокой долей выраженных фибротических изменений. Как полагают, жировая дегенерация гепатоцитов при болезни Вильсона связана с оксидативным повреждением митохондрий с последующим нарушением метаболизма липидов, а воспалительные проявления – с перекисным окислением липидов, генерацией свободных радикалов и истощением запасов глютатиона в результате накопления избытка меди в гепатоцитах. Описаны гистологические изменения печеночной паренхимы по типу аутоиммунного гепатита, вирусного, алкогольного и лекарственного поражения печени. По мере прогрессирования повреждений паренхимы, формируется фиброз и, впоследствии, цирроз печени. Обычно встречается гистологическая картина крупноузлового цирроза печени в исходе болезни Вильсона, однако, описаны случаи и мелкоузлового цирроза.
Для качественного выявления депозитов меди в печеночной ткани используются различные гистохимические методы окраски (родамин, рубеановая кислота, орсеин, метод Тиммса с серой), однако, все они имеют низкую диагностическую ценность.
Неврологические проявления болезни Вильсона
Накопление меди в головном мозге при болезни Вильсона приводит к повреждению базальных ганглиев с развитием гипо- или гиперкинетической экстрапирамидной симптоматики в виде акинетико-ригидного синдрома, атаксии, тремора, дистонического синдрома. Неврологические нарушения развиваются постепенно и без лечения неуклонно прогрессируют. Психические нарушения при болезни Вильсона встречаются в 10% случаев и включают в себя нарушение поведения, агрессию, фобии, мании, психозы, интеллектуальную и когнитивную недостаточность, а также синдромальные состояния: биполярные расстройства, депрессии, дистимии. Описаны также мигрени, головные боли, бессонница, эпилептические приступы у детей с неврологической симптоматикой болезни Вильсона.
Для выявления структурных изменений головного мозга при неврологической симптоматике болезни Вильсона используют МРТ и КТ головного мозга. Наиболее часто выявляются понижение плотности на КТ и гиперинтенсивность сигнала в Т2 и Т1 в режимах МРТ в области базальных ядер головного мозга. Также выявляются изменения сигнала в области ствола головного мозга, таламуса, мозжечка в сочетании с диффузной атрофией коры и белого вещества головного мозга. Изменения МР-сигнала от структур головного мозга могут отсутствовать у 7-17% детей со смешанной формой болезни Вильсона при наличии неврологической симптоматики в виде тремора, дизартрии и изменения мышечного тонуса по экстрапирамидному типу. В тоже время изменения на МРТ и КТ головного мозга могут опережать развитие неврологической симптоматики в 10% случаев болезни Вильсона и быть обратимыми на фоне медьхелатирующей терапии.
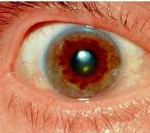
Поражение глаз при болезни Вильсона
Офтальмологические проявления при болезни Вильсона включают в себя кольца Кайзера-Флейшера и медную катаракту по типу «подсолнух». Кольца Кайзера-Флейшера представляют собой отложение депозитов меди на внутренней поверхности роговицы в десцеметовой оболочке. Визуализация кольца Кайзера-Флейшера производится при офтальмологическом осмотре при помощи щелевой лампы, иногда при помощи гониолинз, в далеко зашедших стадиях заболевания можно видеть кольцо невооруженным взглядом. Гораздо реже при болезни Вильсона встречается развитие медной катаракты в виде «подсолнуха». Катаракта не влияет на остроту зрения и визуализируется при помощи щелевой лампы в виде серого или золотого диска на передней оболочке хрусталика, от которого радиально отходят лучи на периферию хрусталика.
Поражение других органов при болезни Вильсона
При болезни Вильсона наблюдается широкий спектр внепеченочных проявлений, однако частота их выявления в педиатрической практике не превышает 10%. К ним относят поражение опорно-двигательного аппарата с выявлением симптомов остеомаляции, остеопороза, остеоартритов, хондропатии, спонтанных переломов, субхондральных кистозных формаций. Наиболее частой локализацией является позвоночник и коленный сустав.
Описаны повреждения мышц при болезни Вильсона, протекающие по типу рабдомиолиза, вследствие поражения мышечных митохондрий.
Отложение избытка меди в сердечной мышце приводит к формированию кардиомиопатий, аритмий, дисфункции синусового узла.
Другими редкими проявлениями болезни Вильсона являются симптомы повреждения желез внутренней секреции, характеризующиеся симптомами гипопаратиреодизма, гиперпролактинемии, аменореи, бесплодия, повторными эпизодами невынашивания беременности.
Поражение почек при болезни Вильсона связано с воздействием избытка меди на проксимальные канальцы. Спектр тубулярных дисфункций разнообразен от выявления повышения экскреции мочевой кислоты с мочой до формирования синдрома Фанкони с аминоацидурией, почечным канальцевым ацидозом, глюкозурией и электролитными нарушениями. Нарушение экскреции электролитов может приводить к нефрокальцинозу.
Гемолитическая анемия выявляется при болезни Вильсона с частотой 1-12% и связана с повышением сывороточного уровня меди в результате некроза гепатоцитов. Гемолитическая анемия может быть острой и ассоциироваться с резким подъемом уровня билирубина, сочетаться с фульминантной печеночной недостаточностью, а также носить слабо выраженный персистирующий характер, приводя к хронической анемии и являясь первым симптомом манифестации болезни Вильсона. Повторные эпизоды гемолитических кризов приводят к развитию желчекаменной болезни. Камни смешанного типа, образованы солями билирубина и холестерина.
Классификация болезни Вильсона
В соответствии с международной классификацией и МКБ 10 используется номенклатура болезнь Вильсона (Е83.0 – нарушение обмена меди). Однако в отечественной литературе также применяется следующая терминология: болезнь Вильсона-Коновалова, гепатолентикулярная дегенерация, гепатоцеребральная дистрофия.
В настоящее время используется классификация, построенная на клинических признаках болезни, сочетания поражения печени и центральной нервной системы, предложенная J.Walsh (1983):
Формы болезни Вильсона (классификация J.Walsh, 1983):
Согласно классификации Н.В. Коновалова распознают 5 форм гепато-церебральной дистрофии (1960), в зависимости от вовлечения в патологический процесс печени и центральной нервной системы и характера экстрапирамидной сиптоматики.
Диагностика болезни Вильсона
Скрининг на болезнь Вильсона должен проводиться у детей в возрасте от 2 до 18 лет, имеющих необъяснимое повышение сывороточных аминотрансфераз, проявления фульминантной печеночной недостаточности, хронического гепатита, цирроза печени, неврологические нарушения неустановленной этиологии, Кумбс-негативную гемолитическую анемию, отягощенный семейный анамнез по болезни Вильсона.
Диагностика болезни Вильсона базируется на комбинации клинических симптомов, данных лабораторного обследования и молекулярно-генетического тестирования и включает в себя следующие параметры:
Ни один лабораторный тест (за исключением полного секвенирования патологического гена АТР7В) не обладает 100% чувствительностью и не обеспечивает 100% специфичность; диагноз болезни Вильсона ставится на основании совокупности клинических данных, результатов лабораторного исследования и молекулярно-генетического анализа.
На VIII интернациональной конференции, посвященной изучению болезни Вильсона и болезни Менкеса (16 – 18 апреля 2001 год, Лейпциг, Германия) была утверждена балльная шкала диагностики болезни Вильсона.
При наличии колец Кайзера-Флейшера, снижения уровня церулоплазмина и повышения базальной экскреции меди с мочой диагноз болезни Вильсона не вызывает сомнений. Однако, в ряде случаев клинические симптомы могут отсутствовать или быть неспецифичными, а лабораторные данные находиться в пределах нормальных величин, что затрудняет скрининговую диагностику болезни Вильсона и требует дальнейшего углубленного обследования пациентов с проведением пункционной биопсии печени с количественной оценкой меди в биоптатах печени и молекулярно-генетического тестирования с целью выявления мутаций гена АТР7В.
Родственники по прямой линии вновь выявленного больного с болезнью Вильсона должны проходить скрининг на наличие у них заболевания. При тщательном сборе анамнеза необходимо уделять внимание на выявление эпизодов желтухи, заболеваний печени, ранней симптоматике неврологических отклонений. Проводится лабораторно-инструментальное обследование пациента с исследованием метаболизма меди (уровень церулоплазмина в сыворотки крови, показатели суточной экскреции меди с мочой, офтальмологический осмотр с целью выявления наличия/отсутствия колец Кайзера-Флейшера), по результатам которого решается вопрос о необходимости проведения биопсии печени с количественной оценкой меди и молекулярно-генетического исследования мутаций гена АТР7В.
Терапия болезни Вильсона
Диагностика и терапия болезни Вильсона у детей осуществляется на базе специализированных стационаров гастроэнтерологического (гепатологического) профиля с привлечением следующих специалистов: гастроэнтеролог (гепатолог), окулист, психоневролог, психолог, трансплантолог. Первичная диагностика и начало терапии у детей с болезнью Вильсона осуществляется на базе специализированного стационара и включает в среднем 30 койко-дней с обязательной оценкой метаболизма меди, степени фиброзирования печеночной паренхимы и нарушения психо-неврологических функций, с определением показаний для своевременного выполнения ортотопической трансплантации печени.
Консервативная терапия проводится на базе круглосуточного или дневного стационара с обязательным контролем лабораторных показателей и последующей преемственностью с амбулаторным звеном здравоохранения: на 1 месяце терапии осуществляется еженедельный контроль лабораторных показателей, на 1 году – ежемесячный, далее 1 раз в 3 месяца, с преемственностью между стационарным и амбулаторным этапом наблюдения.
Специализированное стационарное наблюдение осуществляется 2 раза в год на базе круглосуточного стационара или на базе дневного стационара при отсутствии необходимости заместительной инфузионной терапии, с ежемесячным амбулаторным наблюдением пациентов по месту жительства врачей специалистов: педиатра и гастроэнтеролога при печеночной и смешанной формах заболевания, психоневролога и психолога при смешанной форме болезни Вильсона.
Лечение болезни Вильсона следует начинать с диеты, направленной на уменьшение поступления меди в организм. Ограничиваются продукты с высоким содержанием меди (печень, креветки, орехи, шоколад, грибы). Как минимум, в течение первого года лечения, используется свободная от меди вода, при необходимости устанавливаются очистительные фильтры для контроля уровня содержания меди в водопроводной воде, т.к. при ее доставке могут использоваться медные трубы. Запрещается использовать медную посуду для приготовления пищи и еды. Необходимо избегать витаминные и минеральные препараты, содержащие медь. Диетические рекомендации приводят к замедлению прогрессирования заболевания, однако не могут использоваться как единственная линия терапии.
В настоящее время используются различные препараты для лечения болезни Вильсона, обладающие различным строением и механизмом действия. Д-пеницилламин (Купренил) (Код ATX: M01CC01) является препаратом выбора при лечении болезни Вильсона. Д-пеницилламин представляет собой производное пенициллина, молекула которого содержит свободную сульфидрильную группу, с помощью которой осуществляется хелаторная активность данного препарата. Д-пеницилламин мобилизует медь из печени и других органов и увеличивает ее мочевую экскрецию, а также индуцирует синтез металлотионинов. Д-пеницилламин назначается за 1 час или через 2 часа после приема пищи, т.к. еда снижает кишечную абсорбцию препарата. Начальные дозы при терапии составляют 250-500 мг/сут с постепенным (каждые 4-7 дней) увеличением дозы на 250 мг до лечебной дозировки 1000-1500 мг/сут, которая дается в 2-4 приема. Для детей терапевтическая дозировка Д-пеницилламина составляет 20 мг/кг/сут.
Коррекция дозы препарата производится по мере снижения уровня экскреции меди с мочой.
Побочные эффекты на терапию Д-пеницилламином развиваются в 30% наблюдений. У больных со смешанной (неврологической) формой болезни Вильсона в 30% случаев отмечается ухудшение неврологической симптоматики, что связано с индуцированной высокой мобилизацией меди из печени и отложением ее в базальных ядрах головного мозга, что провоцирует или усиливает неврологическую симптоматику. Около 25-30 % пациентов с болезнью Вильсона на фоне терапии развивают острую аллергическую реакцию в виде сыпи, лихорадки, крапивницы. Возможно развитие подострой токсической реакции в виде протеинурии, угнетения костномозгового кровообращения или хронического токсического действия на кожу (преждевременное старение, дефекты в формировании рубцовой ткани, серпингинозный перфорирующий эластоз, вследствие токсического воздействия на коллагеновые волокна, возможно развитие слабости сосудистой стенки), иммунную систему с развитием аутоиммунных заболеваний (системная красная волчанка, артриты, повышение антинуклеарного фактора), а также снижение резистентности к инфекциям. При применении Д-пеницилламина развивается недостаточность пиридоксина, что требует назначения витамина В6 (пиридоксин) в дозе 25-50 мг/сут. При развитии побочных действий Д-пеницилламина назначается другое альтернативное лечение.
Цинк подавляет всасывание меди в кишечнике и применяется как альтернативное лечение при болезни Вильсона. Препараты цинка (сульфат, окись, ацетат цинка)(Код АТХ: А12СВ) индуцируют металлотионины энтероцитов, обладающих высоким сродством к меди, что приводит к захвату меди из пищи металлотионинами, связыванию в эпителии кишечника, и препятствию абсорбции металла в системный кровоток с выделением избытка меди с калом. Препараты цинка менее токсичны, чем хелаторы.
Кроме того, для лечения болезни Вильсона используются Триентин (триэтилен тетрамин) и Тетрамолибдат аммония (Кода АТХ – нет), однако на Российском фармакологическом рынке данные препараты не зарегистрированы.
Трансплантация печени при болезни Вильсона
Трансплантация печени при болезни Вильсона выполняется по следующим показаниям:
Выживаемость пациентов в течение года после ургентной трансплантации по поводу фульминантной печеночной недостаточности при болезни Вильсона достигает 70%, в отсутствие трансплантации выживаемость составляет единичные случаи. При трасплантации печени на стадии декомпенсированного цирроза печени выживаемость пациентов в течение года составляет 95%, через 5 лет – 83%, через 10 лет – 80%. Улучшение неврологической симптоматики после трансплантации наблюдается более чем в 50% случаев. Однако, если неврологическая симптоматика персистирует более 2 лет на фоне лечения, улучшение результатов после проведения ортотопической трансплантации печени или продолжения хелаторной терапии маловероятно. Выживаемость пациентов со смешанной формой болезни Вильсона после проведения трансплантации печени ниже по сравнению с печеночной формой. Трансплантация печени приводит к нормализации обмена меди, повышению уровня церулоплазмина в первые месяцы после операции, снижению экскреции меди с мочой после трансплантации с полной нормализацией данных показателей к 6-9 месяцу послеоперационного периода, исчезновению колец Кайзера-Флейшера у большинства пациентов.
Прогноз и исходы болезни Вильсона
Болезнь Вильсона является прогрессирующим заболеванием и при отсутствии своевременной терапии больные умирают от осложнений цирроза печени и/или реже от прогрессирующей неврологической симптоматики. При хелирующей терапии и трансплантации печени длительная выживаемость пациентов с болезнью Вильсона стала нормой, хотя и не оценивалась проспективно. Прогноз при болезни Вильсона связан со степенью декомпенсации печеночных функций, тяжестью неврологической симптоматики и приверженностью терапии. Нормализация печеночных функций происходит на 1-2 году терапии и не прогрессирует при полном выполнении всех рекомендаций. Консервативная терапия не эффективна при фульминантном течении заболевания. Был разработан прогностический индекс болезни Вильсона (Dhawan et al.), согласно которому оценка свыше 11 баллов связана с высокой вероятностью летального исхода при отсутствии срочной ортотопической трансплантации печени. Неврологическая симптоматика болезни Вильсона частично обратима при терапии хелаторами и проведении трансплантации печени, что связано с необратимыми поражениями подкорковых ядер головного мозга токсическими концентрациями меди.