Синдром миллера дикера что это
Миллера-Дикера синдром
OMIM 247200
Наша команда профессионалов ответит на ваши вопросы
Синдром Миллера-Дикера (синдром лиссэнцефалии Миллера-Дикера OMIM 247200) – аутосомно-доминантное заболевание, обусловленное делецией генов локуса 17p13.3 (размер критического региона около 350-400 килобаз). Делеция локуса 17p13.3 приводит к нарушению миграции нейронов и в основном возникает de novo (образуется кольцевая хромосома, либо происходит делеция концевого участка короткого плеча), однако она может наследоваться от родителя со сбалансированной реципрокной транслокацией. Делеции всего гена PAFAH1B1 (другое название LIS1), лежащего в этом локусе, его отдельных экзонов и точковые мутации в нем приводят к развитию изолированной лиссэнцефалии. Формирование специфического фенотипа и более тяжелого течения заболевания при синдроме Миллера-Дикера связано с делецией более протяженного участка хромосомы, захватывающей несколько генов, в частности ген YWHAE, лежащий рядом с геном PAFAH1B1. Описаны случаи делеции только гена YWHAE. При этом у больных формируется фенотип, как при синдроме Миллера-Дикера (задержка роста, черепно-лицевые аномалии, задержка умственного развития), однако наблюдаются иные аномалии развития мозга, среди которых наиболее частыми являются расширение пространств Вирхова-Робина, мальформация Киари I, аномалии мозолистого тела. Описано также несколько случаев дупликации локуса 17p13.3, что также приводило к развитию синдрома Миллера-Дикера. Популяционная частота заболевания неизвестна.
В Центре Молекулярной Генетики методом количественной MLPA проводится поиск делеции / дупликации локуса локуса 17p13.3 и прямое автоматическое секвенирование гена PAFAH1B1.
Публикации в СМИ
Агирия
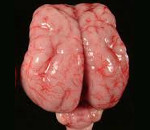
Агирия (лиссэнцефалия, агирия–пахигирия) — дефект развития в виде слабой выраженности извилин коры головного мозга вследствие нарушения миграции нейробластов в эмбриогенезе. Агирия типа I — основное проявление синдромов Миллера–Дикера и Нормана–Робертса. Агирия типа II (кортикальная дисплазия) — нарушение цитоархитектоники с облитерацией субарахноидального пространства эктопической нейроглиальной тканью и гидроцефалией — компонент синдрома Уокера–Варбурга, врождённой мышечной дистрофии Фукуяма (253800) и некоторых других семейных синдромов.
• Миллера–Дикера синдром агирии (агирия типа I, *247200, три локуса: 17p.13.3, ген LIS1 [601545, в 90% — делеция]; 2p11.2, ген LIS2 [*600217]; второй локус 2q13, r ): микроцефалия, агирия (утолщённая кора с 4 слоями клеток) в сочетании с дефектами развития лицевого скелета и множественными пороками развития внутренних органов.
• Нормана–Робертса синдром — вариант агирии I типа с микроцефалией, низким покатым лбом и выступающей спинкой носа (*257320, r ); в отличие от синдрома Миллера–Дикера, делеции в хр. 17 не обнаружено.
• Уокера–Варбурга синдром (агирия типа II, *236670): сочетание агирии с обструктивной гидроцефалией (микрополигирия).
• Агирия X-сцепленная (*300067, Xq22.3–q23, ген LISX, À доминантное): сочетание агирии с агенезией мозолистого тела.
• Пахигирия с умственной отсталостью и судорожными припадками (600176, r ): тяжёлая энцефалопатия, умственная отсталость, задержка психомоторного развития, генерализованные клоникотонические судороги, утолщение коры мозга до 10–12 мм на МРТ.
МКБ-10. Q04.3 Другие редукционные деформации мозга
Код вставки на сайт
Агирия
Агирия (лиссэнцефалия, агирия–пахигирия) — дефект развития в виде слабой выраженности извилин коры головного мозга вследствие нарушения миграции нейробластов в эмбриогенезе. Агирия типа I — основное проявление синдромов Миллера–Дикера и Нормана–Робертса. Агирия типа II (кортикальная дисплазия) — нарушение цитоархитектоники с облитерацией субарахноидального пространства эктопической нейроглиальной тканью и гидроцефалией — компонент синдрома Уокера–Варбурга, врождённой мышечной дистрофии Фукуяма (253800) и некоторых других семейных синдромов.
• Миллера–Дикера синдром агирии (агирия типа I, *247200, три локуса: 17p.13.3, ген LIS1 [601545, в 90% — делеция]; 2p11.2, ген LIS2 [*600217]; второй локус 2q13, r ): микроцефалия, агирия (утолщённая кора с 4 слоями клеток) в сочетании с дефектами развития лицевого скелета и множественными пороками развития внутренних органов.
• Нормана–Робертса синдром — вариант агирии I типа с микроцефалией, низким покатым лбом и выступающей спинкой носа (*257320, r ); в отличие от синдрома Миллера–Дикера, делеции в хр. 17 не обнаружено.
• Уокера–Варбурга синдром (агирия типа II, *236670): сочетание агирии с обструктивной гидроцефалией (микрополигирия).
• Агирия X-сцепленная (*300067, Xq22.3–q23, ген LISX, À доминантное): сочетание агирии с агенезией мозолистого тела.
• Пахигирия с умственной отсталостью и судорожными припадками (600176, r ): тяжёлая энцефалопатия, умственная отсталость, задержка психомоторного развития, генерализованные клоникотонические судороги, утолщение коры мозга до 10–12 мм на МРТ.
МКБ-10. Q04.3 Другие редукционные деформации мозга
СИНДРОМ МИЛЛЕРА-ДИКЕРА
В настоящее время значительно увеличилось рождение детей, страдающих тем или иным заболеванием с разной частотой появления в популяции, одни из которых могут не сильно сказываться на жизнедеятельности, а другие – могут резко ее ограничивать. Так, синдром, который я выбрала для изучения, обусловлен тяжелой задержкой психического и моторного развития ребенка с проявлением в большинстве случаев эпилептических приступов.
Цель данной работы состоит в изучении синдрома Миллера-Дикера.
1.Рассмотреть причины появления данного синдрома;2. Ознакомиться с классической лиссэнцефалией;
3. Изучить методы диагностики синдрома Миллера-Дикера;
4. Разобрать проявление синдрома на примере клинического случая
Синдром Миллера-Дикера
Синдром Миллера-Дикера (СМД) – редкое генетическое заболевание, обусловленное микроделециями в участке 17р13.3 и характеризующееся классической лиссэнцефалией в сочетании с лицевым дисморфизмом. Классическая лиссэнцефалия (тип 1, форма Бильшовского) проявляется малыми размерами мозга, утолщением коры, состоящей из 4 аномальных слоев с формированием только первичных и нескольких вторичных извилин. Возможны гипоплазия коры мозжечка, камптодактилия I-III пальцев стоп, врожденные пороки сердца, агенезия почек, крипторхизм, паховые грыжи [3, с.142].
В некоторых случаях классической лиссэнцефалии возникает гемизиготная или гетерозиготная мутация в гене DCX, кодирующим белок даблкортин на Х хромосоме. Эта мутация может быть спонтанной или возникает в результате передачи по материнской линии. Женщины носительницы такого гена могут быть клинически здоровы или иметь подкорковую ленточную гетеротопию [4, с.61].
Классическая лиссэнцефалия – тяжёлая мальформация головного мозга человека, при которой поверхность больших полушарий сглажена; морфологически определяются первичные и единичные вторичные извилины; кора утолщена и состоит из 4 примитивных слоёв: молекулярный, поверхностный клеточный, губчатый и глубокий клеточный. Большинство нейронов в обоих клеточных слоях ориентированы аномально – косо или апикальными дендритами вниз. Глубокий клеточный слой состоит из эктопированных нейронов, остановившихся в процессе внутриутробной миграции из герминальных слоёв на 12 неделе гестации.
В общей популяции распространённость заболевания составляет 1-4 случаев на 100 тысяч. У пациентов с классической лиссэнцефалией частота встречаемости СМД достигает 30%. Синдром Миллера-Дикера проявляется классической лиссэнцефалией в сочетании с краниофациальными аномалиями. Для больных СМД характерно лиссэнцефалия 1-2 степени: тотальная агирия или агирия с участками пахигирии в лобно-височных областях. Больные имеют характерный внешний вид: высокий выступающий лоб, впалые виски, короткий нос с широкой переносицей и вздёрнутым кончиком, маленькая нижняя челюсть, тонкая выступающая кпереди верхняя губа. Другие нарушения встречаются несколько реже: эпикант, гипертелоризм, низкопосаженные ротированные назад уши. При рождении окружность головы может быть нормальной или уменьшенной, но в дальнейшем рост головы замедляется, поэтому у пациентов старше года – микроцефалия.
В пренатальном периоде наблюдается задержка внутриутробного развития и снижения двигательной активности плода. Беременность протекает на фоне многоводья. У новорожденных констатируется генерализованная гипотония, которая сменяется нарастающей спастичностью и тетрапарезом с позой опистотонуса. Для всех пациентов характерна тяжелая задержка моторного и психического развития. В большинстве случаев из приобретённых навыков у детей отмечается короткие и непостоянные эпизоды слежения глазами и улыбка, в редких случаях – контроль головы и способность переворачиваться на бок [4, с.62].
Эпилептические приступы – частный симптом при синдромах Ангельмана и Миллера-Дикера, а также нередко встречается при трисомии 21 хромосомы или при синдроме фрагильной Х-хромосомы [5, с.38]. Наблюдается более чем у 90% больных, проявляются инфантильными спазмами, миоклоническими, генерализованными тоническими спазмами, простыми и сложными фокальными, вторично-генерализованными, атипичными абсансами [2, с.35]. В 75% случаев приступы начинаются на первом полугодии жизни, у 50% пациентов – в первые три месяца. Типично начало заболевания с массивных билатеральных миоклонических приступов или инфантильных спазмов без типичной гипсоретмии на ЭЭГ. На первых месяцах жизни инфантильным спазмам могут предшествовать тонические приступы или эпизоды иктальных апноэ. У больных старше одного года наиболее частым типом приступа является короткие генерализованные тонические спазмы, нередко возникающие серийно. В старшем возрасте характерна комбинация фокальных и псевдогенерализованных приступов. Констатируется атипичные абсанции, миоклонические пароксизмы, а так же фокальные моторные и аутомоторные, вторично-генерализованные тонико- клонические приступы. Приступы резистентны к терапии АЭП.
Из экстроневральных нарушения часто встречаются врождённые пороки сердца, пороки органов мочеполовой системы, нарушения закладки конечностей и позвоночного столба [4, с.62].
При ЭЭГ исследовании у больных СМД практически отсутствует пространственная организация основной активности, а также ЭЭГ различия сна и бодрствования. Отличительным ЭЭГ признаком в межприступном периоде является диффузная быстрая активность с амплитудой до 100 мкВ и акцентом в лобно-центральных отведениях. Быстрая активность появляется после 6 месяцев и комбинируется с дельта волнами. У больных после полутора лет диффузная быстрая активность постепенно становится доминирующей. Она не блокируется при записи с открытыми глазами и слабо модифицируется во сне.
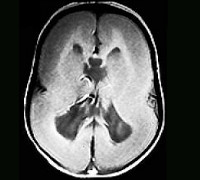
Основным методом верификации лиссэнцефалии при СМД является МРТ. Главный признак лиссэнцефалии при МРТ исследовании – изображение коры головного мозга в виде песочный часов. Кора при нейровизуализации напоминает мозг плода 13 недели гестации. Поверхность полушария почти полностью гладкая, за исключением нескольких борозд на нижней и боковой поверхности мозга. Характерно утолщение коры до 20мм. При LIS1, классическом генотипе СМД, морфологические изменения максимально выражены в теменно-затылочных отделах коры; при генотипе DCX – лобных и частично височных. При мутации этого гена выражена гипоплозия червя мозжечка. В стволе наблюдается эктопия ядер олив, гипоплазия пирамид. У 40% больных СМД обнаруживаются церебральные кальцификаты, локализованные по средней линии, которые отсутствуют при изолированной лиссэнцефалии. При лиссэнцефалии, обусловленной цитомегаловирусной инфекцией, могут обнаруживаться перивентрикулярные кальцификаты, которые не имеют отношения к СМД [4, с.63].
Клинический случай синдрома
Больная К.Д., 3 года. В возрасте ребенка 12 месяцев семья впервые обратилась за консультацией в Центр Детской Неврологии и Эпилепсии. Жалобы на частые эпилептические приступы и тяжелую задержку психо-моторного развития.
Из анамнеза заболевания известно, что в 2,5 мес. девочка была госпитализирована в отделение реанимации в связи с внезапно возникшей в ночное время серией эпизодов следующего характера: «сжималась», наблюдалось тоническое напряжение тела с клоническими подергиваниями дистальных отделов конечностей. Приступы протекали серийно, с потерей сознания; длительность каждого эпизода около 2 минут. Был назначен депакин хроно 300 в дозе 300мг/сут, на фоне приема которого отмечалось урежение приступов. В возрасте 6 мес появились эпизоды подергивания век, заведение глазных яблок вверх, нередко сопровождающиеся закидыванием головы назад. С частотой до 5 раз/сутки отмечались приступы, начинающиеся с кивка с последующим тоническим напряжением правой руки. В возрасте 8 мес был назначен синактен-депо, и приступы не отмечались в течение 3 месяцев. На момент первичной консультации у ребенка наблюдались симметричные тонические экстензорные приступы по типу спазмов длительностью по 3 секунды, возникающие сериями. Также нередко приступы начинались с икоты. После назначения фенобарбитала и депакино хроно было отмечено урежение частоты приступов, однако ремиссия достигнута не была. В настоящее время у пациентки возникает 2 типа эпилептических приступов: первый тип – заведение глаз с вертикальным инстагмом и легким запрокидыванием головы (до 5 р/сут), второй тип – заведением глаз с тоническим напряжением туловища и конечностей: сгибание ручек в локтевых суставах и заведением их за голову, иногда с приведением к животу ножек, обычно после пробуждения [4, с.63].
Из анамнеза жизни известно, что ребенок от второй беременности (при первой – выкидыш). Беременность постоянно протекала с угрозой прерывания. Роды на 36 неделе гестации. Девочка родилась с весом 2,5 кг, окружностью головы 33 см. ребенок развивался с выраженной задержкой психического и моторного развития. При этом семейный анамнез не отягощен.
При осмотре определяется выраженный краниофациальный дисморфизм: микроцефалия, выступающий лоб, впалые виски, низко посаженные оттопыренные ушные раковины, короткий нос с широкой переносицей и вздернутым кончиком, эпикант, маленькая нижняя челюсть, укорочение дистальных фаланг пальцев рук.
Неврологический статус: практическое полное отсутствие развития ребенка: с трудом контролирует голову, не ползает, не может переворачиваться, не сидит. Взгляд прослеживает, периодически возникает «комплекс оживления» при виде матери; инструкции не выполняет, речь полностью отсутствует. Псевдобульбарный парез, глотает только жидкую пищу. Сходящееся косоглазие. Гипомимия. Тетрапарез, более выраженный в ногах, при диффузно сниженном мышечном тонусе. Сухожильные рефлексы равномерно повышены, зона расширена; определяются патологические стопные и кистевые пирамидные симптомы. Брюшные рефлексы угнетены. Тазовые функции не контролирует. В контакт не вступает, игрушками также не интересуется.
Видео-ЭЭГ мониторинг: биоэлектрическая активность головного мозга представлена высокоамплитудными диффузными медленными волнами в сочетании с медленными комплексами пик/полипик-волна, острая-медленная волна, низкой степени синхронизации. Также отмечается амплитудное преобладание эпилептиформной активности в задних отделах, максимально выраженное по правым затылочным электродам с реверсией фазы; амплитуда уменьшается по мере приближения к лобным отделам, где эпилептиформные проявления минимальны. В состоянии бодрствования зарегистрированы тонические эпилептические спазмы, исходящие из правых затылочных отведений.
При проведении МРТ была выявлена тотальная агирия-лиссэнцефалия. Кортикальная складчатость резко обеднена, основные борозды и извилины не сформированы. Кора патологически утолщена; в субкортикальном белом веществе регистрируется диспластическая дисмиелинизация, объем белого вещества снижен. Боковые желудочки диспластически расширены [4, с.64].
Таким образом, в ходе работы ознакомилась с проявлением синдрома Миллера-Дикера на рассмотренном клиническом случае, который характеризуется краниофациальными аномалиями, выраженной психической и моторной задержкой в развитии, а также ранним дебютом эпилептических приступов. Синдром может быть установлен при сочетании с классической лиссэнцефалией. Также большинство детей умирает до раненого детского возраста. Поэтому родителям необходимо проходить такие исследования, как МРТ, картирование.
Лиссэнцефалия
Лиссэнцефалия – группа генетически обусловленных аномалий развития головного мозга, характеризующихся частичным или полным недоразвитием извилин и борозд коры больших полушарий, а также нарушением ее ультраструктуры. Выраженность и сочетания симптомов этого состояния различаются при разных формах заболевания, наиболее распространены судороги, глубокая умственная отсталость, нарушения глотания и гипотония мышц. Диагностика лиссэнцефалии может производиться ультразвуковыми методиками (в том числе и пренатально), компьютерной и магнитно-резонансной томографией, для наиболее распространенных форм возможно определение посредством молекулярно-генетического анализа. Специфического лечения не существует, используют симптоматическую и поддерживающую терапию.
Общие сведения
Лиссэнцефалия – группа тяжелых аномалий развития головного мозга, которые сопровождаются недоразвитием коры больших полушарий с формированием пахигирии (наличием всего нескольких извилин и борозд) или агирии (полным отсутствием складчатости коры). Данная патология может выступать в качестве самостоятельного генетического заболевания или входить в симптомокомплекс других синдромов – например, Миллера-Дикера, Фукуямы и Уокера-Варбурга. Механизм наследования различных типов лиссэнцефалии может быть аутосомно-рецессивным, аутосомно-доминантным (в данном случае чаще всего имеют место спонтанные или герминативные мутации) и сцепленным с Х-хромосомой. Из-за многообразия механизмов наследования половое распределение нарушения неодинаково при различных формах патологии. Лиссэнцефалия является достаточно редкой генетической аномалией развития мозга, поэтому встречаемость определена только для наиболее распространенной первой группы нарушений – она составляет 11,7 случаев на 1 000 000 новорожденных. Для остальных групп лиссэнцефалии встречаемость не установлена, в том числе и потому, что во многих случаях плод с подобной патологией не вынашивается, и беременность самопроизвольно прерывается в первом триместре еще до определения наличия порока.
Причины лиссэнцефалии
Основная общая причина всех типов лиссэнцефалии – нарушение процесса миграции клеток-предшественников нейронов (нейробластов) из передних отделов нервной трубки к будущей коре больших полушарий. В результате этого вместо сложной складчатой структуры, которая имеет в своем составе шесть слоев, образуется гладкая или имеющая в разы меньше борозд кора, состоящая из 2-4 слоев (в зависимости от формы заболевания). Поскольку кора больших полушарий у человека отвечает за когнитивные функции, в ней содержится огромное число нервных центров и обширные ассоциативные зоны, лиссэнцефалия приводит к тяжелейшим расстройствам. Кроме того, при некоторых типах мутаций, вызывающих данное состояние, возможно развитие аномалий других органов и тканей, что еще больше усугубляет состояние больного.
Наиболее распространенные типы лиссэнцефалии обусловлены дефектами гена PAFAH1B1, также известного под названием LIS1 и расположенного на 17-й хромосоме. Многие врачи-генетики отмечают, что для возникновения выраженного недоразвития коры головного мозга и синдрома Миллера-Дикера необходимы не точечные мутации в LIS1, а крупные делеции с захватом сотен пар азотистых оснований. Нередко при этом повреждаются и окружающие гены, что становится причиной разнообразных фенотипических проявлений данного типа лиссэнцефалии. Ген LIS1 кодирует внутриклеточную субъединицу сложного по своей структуре фермента, который принимает активное участие в миграции нейробластов. Дефекты в структуре этой субъединицы приводят к нарушению данного процесса и развитию данного заболевания.
Другая форма лиссэнцефалии обусловлена мутацией гена DCX, локализованного на Х-хромосоме, поэтому наследование этого типа патологии сцеплено с полом. Белок, получаемый в результате экспрессии данного гена, участвует в формировании особого типа микротрубочек, которые вырабатываются только нейробластами и необходимы им для формирования связей между клетками. Нарушения в структуре DCX приводят к синтезу дефектного белка, что провоцирует лиссэнцефалию. Другой относительно изученный вариант этого состояния, также сцепленный с Х-хромосомой, вызывается мутациями гена ARX, который является фактором транскрипции для иных генов. Он контролирует развитие коры больших полушарий, поджелудочной железы и половых органов, из-за чего дефекты ARX проявляются многочисленными пороками данных органов, в том числе лиссэнцефалией.
Еще одним распространенным вариантом лиссэнцефалии является форма заболевания, обусловленная мутацией гена RELN, расположенного на 7-й хромосоме. Дефекты этого гена приводят к так называемому синдрому Норман-Робертса, который, помимо прочего, сопровождается выраженным нарушением складчатости коры больших полушарий. Ген RELN кодирует последовательность гликопротеида рилина, который принимает активное участие в формировании нервной ткани, а также контролирует образование новых дендритов и функционирование долговременной памяти у взрослых людей. Удалось идентифицировать еще один ген, приводящий к развитию лиссэнцефалии – TUBA1A, который локализован на 12-й хромосоме. Он кодирует определенный компонент цитоскелета нейронов, его дефект приводит к неполноценности нейробластов, что нарушает процесс их миграции в эмбриональном периоде.
Классификация лиссэнцефалии
На сегодняшний день выявлено более двадцати вариантов лиссэнцефалии. Эти варианты обусловлены различными мутациями, имеют отличия в фенотипических проявлениях заболевания, разные механизмы наследования и тяжесть симптомов. Долгое время разновидности патологии не удавалось успешно классифицировать из-за значительного разнообразия генетических дефектов и недостаточных данных о ключевых генах, приводящих к развитию некоторых форм заболевания. Лишь в 2003-м году удалось создать достаточно приемлемую с точки зрения современной генетики и неврологии классификацию лиссэнцефалии, которая учитывает основные нюансы этого состояния. Специалисты разделяют все формы лиссэнцефалии на пять классов:
Данная классификация критикуется некоторыми исследователями по причине наличия большого количества «белых пятен» в виде включения в нее форм лиссэнцефалии с неопределенными ключевыми генами. Однако в настоящее время именно это разделение считается наиболее общепринятым в научном мире. Классификация корректируется по мере дальнейшего изучения данного состояния.
Симптомы лиссэнцефалии
Основными проявлениями лиссэнцефалии являются мышечная слабость, выявляемая уже при рождении, частые расстройства глотания и сосания, судорожные припадки, сильное отставание в физическом и умственном развитии. Выраженность тех или иных проявлений заболевания зависит от наличия пороков развития как головного мозга, так и других органов и систем, а также от степени недоразвития коры. Наиболее тяжелые формы патологии наблюдаются при наличии полной агирии. Иногда больные лиссэнцефалией могут доживать до подросткового и даже взрослого возраста, глубокое недоразвитие центральной нервной системы сохраняется в течение всей жизни. Некоторые пациенты проживают жизнь на грани вегетативного состояния. Летальный исход при лиссэнцефалии наступает из-за осложнений, обусловленных пороками других органов и систем, а также из-за вторичных пневмоний, сердечно-сосудистых и иных аномалий.
Диагностика и лечение лиссэнцефалии
В отношении лиссэнцефалии возможна пренатальная диагностика при помощи ультразвуковых методов исследования, при этом увеличение разрешающей способности УЗИ-аппаратуры способствует все более раннему определению заболевания. Развитие нарушений в строении коры больших полушарий происходит на 14-20-й неделе гестации, в настоящее время уже в этот период можно определить патологию и поставить вопрос о прерывании беременности. После рождения ребенка с подозрением на лиссэнцефалию диагноз подтверждают при помощи КТ и МРТ. Молекулярно-генетическая диагностика обладает высокой точностью, но она доступна только в отношении тех форм заболевания, для которых известны ключевые гены. Специфического лечения лиссэнцефалии не существует, применяют противосудорожные препараты, ноотропы и другие средства, позволяющие уменьшить выраженность симптоматики. При наличии иных пороков развития производится их коррекция по медицинским показаниям.
Прогноз и профилактика лиссэнцефалии
Прогноз практически любой формы лиссэнцефалии крайне неблагоприятный, большинство больных умирает в раннем детстве от осложнений и других пороков развития. Описаны отдельные легкие случаи этого состояния с частичным или очаговым недоразвитием коры больших полушарий, но не все специалисты склонны причислять такие типы патологии к лиссэнцефалиям. Профилактика возможна только в рамках пренатальной диагностики. При наличии в роду подобных заболеваний имеет смысл провести генетический анализ на носительство генов аутосомно-рецессивных типов патологии. При обнаружении у плода нарушений формирования мозга, соответствующих лиссэнцефалии, ставится вопрос о прерывании беременности.