Синдром лизиса опухоли что это такое
Синдром лизиса опухоли что это такое
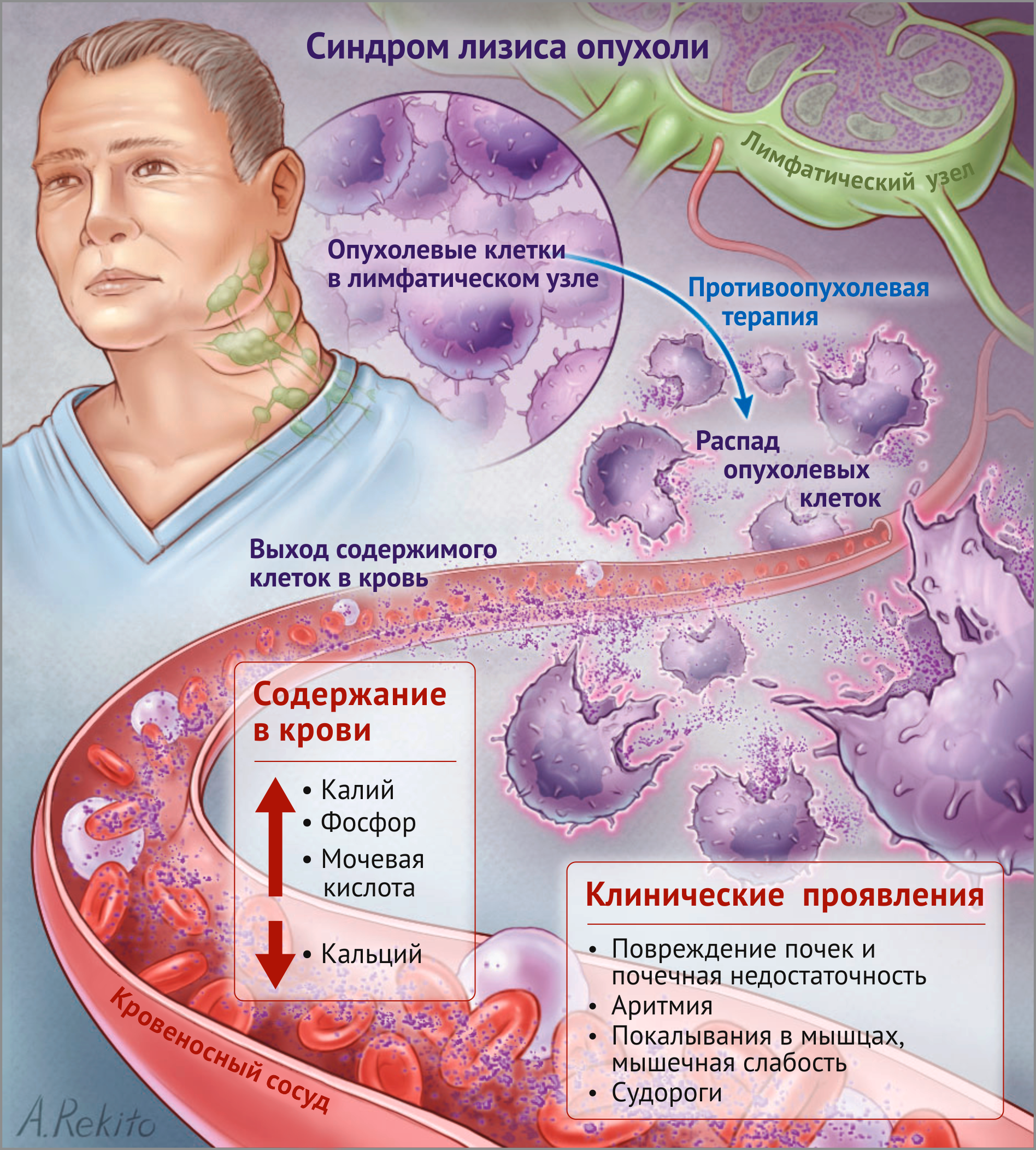
Острое метаболическое расстройство может происходить в результате быстрого разложения опухоли, следующего за химиотерапией. Это наиболее вероятно появляется у детей с лимфомой Беркитта или острой лимфобластической лейкемией и неходжкинской лимфомой у детей, подростков и молодых людей. Синдром появляется, когда опухоль высокочувствительна к лечению, и практически не встречается у взрослых людей с нелимфоидными неоплазмами. Масса опухоли может исчезать очень быстро, и ее умершие клетки высвобождают продукты метаболизма азота, особенно мочевину, мочевую кислоту и большие количества фосфата.
Быстрое уменьшение в массе опухоли вызывает гиперурикемию, гиперфосфатемию, гиперкалиемию и уремию.
Гиперурикемия может приводить к острому осаждению мочевой кислоты в почечных канальцах (уратная нефропатия), что ведет к острой почечной недостаточности, или, менее кардинально, к уменьшению скорости гломерулярной фильтрации, которая обостряет гиперурикемию. Иногда синдром достаточно серьезен, вызывает острую или продолжительную уремию. Гипефосфатемия приводит к снижению уровня кальция в плазме и даже к тетании.
Синдром чаще наблюдается у детей с лимфомой Беркитта, у которых была экстенсивная болезнь, особенно при наличии интра-абдоминальных масс, с ухудшенной почечной функцией из-за опухолевой инфильтрации почек или постренальной обструкцией из-за увеличения лимфоидных узлов.
Синдром редко встречается у взрослых, так как у них опухоли менее чувствительны к действию химиотерапии, и их растворение происходит менее быстро. Это может, однако, случиться, если имеется соответствующая почечная недостаточность, вызванная какой-либо другой причиной, мочевая обструкция или инфильтрация почек опухолью.
Синдром лизиса опухоли можно предотвратить. Перед началом химиотерапии пациенту с высоким риском рекомендуется давать аллопуринол (обычно через рот) в общей дозе (50-100 мг каждые 8 ч для детей, дважды в день ту же дозу для взрослых) в течение 24 ч. Этот ингибитор ксантин-оксидазы частично предотвратит формирование мочевой кислоты. Предшественники, ксантин и гипоксантин, таким образом, присутствуют в большом избытке, но они более растворимы, чем мочевая кислота и не вызывают нефропатию.
Прием аллопуринола рекомендуется продолжать принимать в первые несколько дней лечения и прекратить, когда уровень мочевой кислоты в плазме будет на нормальном уровне. Если при этом давать 6-меркаптопурин, то доза должна быть уменьшена, так как аллопуринол ингибирует его метаболизм. В то же время пациент должен употреблять достаточное количество жидкостей, обычно в форме внутривенного солевого раствора, для того чтобы обеспечить хороший диурез. Эти меры должны предотвратить и гиперурикемию, и гиперфосфатемию.
При лимфоме Беркитта введение химиотерапии иногда дается в уменьшенных дозах до тех пор, пока уменьшение опухоли не будет значительным, затем принимается полная доза. Аллопуринол рекомендовано давать взрослым с начальным лечением высокодифференцированной лимфомы с интенсивной химиотерапией; его использование должно быть рассмотрено в остальных случаях, если существует некоторая возможность ухудшения работы почек.
Развившиеся гиперурикемию и острую почечную недостаточность обычно лечат приостановлением химиотерапии, осмотрительным применением внутривенных жидкостей с подщелачиванием мочи для обеспечения выведения мочевой кислоты и аллопуринолом. Если уровень мочевины в крови и уровень мочевой кислоты в плазме продолжают расти, понадобится перитонеальный диализ для того, чтобы преодолеть острую почечную недостаточность пациента. Если приняты меры профилактики, это редко бывает необходимо.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
— Вернуться в оглавление раздела «Онкология»
Синдром распада опухоли
Синдром распада опухоли – симптомокомплекс, обусловленный быстрым разрушением большого количества клеток злокачественной неоплазии. Обычно возникает при лечении болезней системы крови, реже – при терапии других онкологических заболеваний. Сопровождается метаболическими расстройствами, которые становятся причиной развития аритмии, брадикардии, судорог, расстройств сознания, острой почечной недостаточности, поноса или запора, тошноты, рвоты, кишечной непроходимости и других нарушений деятельности различных органов и систем. Диагностируется на основании симптомов и данных лабораторных анализов. Лечение – инфузионная терапия, симптоматическая терапия, гемодиализ.
Общие сведения
Синдром распада опухоли – ургентное состояние, возникающее в процессе консервативного лечения онкологических заболеваний. Чаще всего диагностируется при острых лимфобластных лейкозах и лимфомах, реже – при хронических лейкозах и солидных новообразованиях различной локализации. Синдром распада опухоли обычно выявляется на фоне приема химиопрепаратов или после завершения химиотерапии, реже наблюдается при проведении лучевой терапии, в отдельных случаях развивается спонтанно. Сопровождается возникновением острой почечной недостаточности, обусловленной гиперурикемией. Представляет угрозу для жизни больного, требует неотложной коррекции. Лечение осуществляют специалисты в сфере онкологии, урологии и реаниматологии.
Причины
Обычно синдром распада опухоли развивается в процессе лечения злокачественных новообразований, что обусловлено интенсивным разрушением клеток опухоли под действием химиопрепаратов либо лучевой терапии. Лейкозы и лимфомы, особенно – лимфома Беркитта имеют изначальную склонность к такому распаду, усугубляющуюся после начала лечения. Риск развития синдрома распада опухоли увеличивается при новообразованиях больших размеров. Из-за относительно медленного роста сосудов, не успевающих за быстрой пролиферацией опухолевых клеток, в крупных опухолях часто образуются участки с недостаточным кровоснабжением. Эти участки могут некротизироваться как спонтанно, так и при проведении терапии, травматизации неоплазии или ухудшении кровообращения, обусловленном различными факторами (изменением состояния больного, сдавлением крупного питающего сосуда и т. д.).
При синдроме распада опухоли в течение короткого периода времени разрушается большое количество злокачественных клеток, содержащих фосфаты и пуриновые нуклеотиды. Нуклеотиды метаболизируются в печени с образованием мочевой кислоты. В крови резко возрастает уровень мочевой кислоты, фосфора, калия и некоторых других веществ. Наряду с перечисленными расстройствами при синдроме распада опухоли развивается лактацидоз, обусловленный нарушением функций печени вследствие поражения отдаленными метастазами и/или токсического воздействия продуктов распада неоплазии на клетки органа.
Возникают характерные для синдрома распада опухоли расстройства кислотно-щелочного и водно-солевого обмена, оказывающие негативное влияние на деятельность всех органов и систем. Все это происходит на фоне истощения, метастатического поражения лимфоузлов и отдаленных органов, лейкоцитоза, анемии, расстройств иммунитета и предшествующего накопления токсичных метаболитов в крови, что еще больше ухудшает ситуацию и может стать причиной резкой декомпенсации состояния пациента с синдромом распада опухоли.
Из-за закисления крови снижается pH мочи. Кристаллы мочевой кислоты осаждаются в мозговом веществе, собирательных трубочках и почечных канальцах, препятствуя фильтрации и выведению мочи. Отмечается снижение почечного клиренса и уменьшение скорости фильтрации почек. Дополнительным фактором, усугубляющим нарушения функции почек при синдроме распада опухоли, является гиперфосфатемия, сочетающаяся с гипокальциемией. Из-за снижения уровня кальция в крови повышается уровень паратиреоидного гормона, стимулирующего выведение фосфатов из организма.
В результате действия этого гормона в ткани почек пациентов с синдромом распада опухоли откладываются соли кальция, также препятствующие фильтрации и выведению мочи. Возникают азотемия, олиго- или анурия, сопровождающиеся накоплением токсичных продуктов обмена в организме. Развивается острая почечная недостаточность, представляющая угрозу для жизни больного синдромом распада опухоли. Гипокальциемия и гиперкалиемия становятся причиной нарушений деятельности сердечно-сосудистой системы. Расстройства обмена влекут за собой нарушения функций центральной нервной системы и системы пищеварения.
Выделение распадающимися клетками ферментов, образование очагов некроза и снижение иммунитета способствуют развитию воспаления, присоединению инфекции и последующему нагноению в зоне распада новообразования и прилегающих тканей. Инфекционные осложнения еще больше ухудшают состояние больного с синдромом распада опухоли, затрудняют процесс лечения и могут становиться причиной развития сепсиса. Еще одним опасным осложнением данного состояния является расплавление крупного сосуда, сопровождающееся обильным кровотечением.
Симптомы синдрома распада опухоли
Развитие синдрома распада опухоли сопровождается ухудшением состояния больного. Возникают прогрессирующая слабость и гипертермия. Отмечаются диспепсические расстройства: боли в животе, тошнота, рвота, отсутствие аппетита, запоры или диарея. При поражении ЦНС наблюдаются судороги, парестезии и нарушения сознания. Поражение сердечно-сосудистой системы при синдроме распада опухоли проявляется брадикардией, аритмией и артериальной гипотонией. О развитии почечной недостаточности свидетельствуют олигоурия или анурия. У пациентов с синдромом распада опухоли нередко возникает желтушность кожных покровов вследствие нарушения функций печени.
Наряду с общей симптоматикой наблюдаются проявления, обусловленные локализацией новообразования. При распаде рака молочной железы образуются крупные язвы. Синдром распада опухоли желудка и кишечника может осложняться расплавлением сосуда с последующим кровотечением или перфорацией стенки органа и развитием перитонита. При распаде рака легкого возможны кровотечения, возникновение пневмоторакса и отхождение обильной гнилостной мокроты.
Диагностика
Диагноз выставляют на основании клинических проявлений, данных лабораторных анализов и инструментальных исследований. Первым настораживающим признаком обычно становится уменьшение количества выделяемой мочи. Для выявления синдрома распада опухоли определяют уровень креатинина, мочевой кислоты, фосфатов и кальция в сыворотке крови. Оценивают состояние печени с учетом результатов печеночных проб. При необходимости назначают ЭКГ, КТ и УЗИ почек.
Лечение синдрома распада опухоли
Незначительные обменные нарушения корректируют в амбулаторных условиях. При появлении признаков развернутого синдрома распада опухоли пациентов госпитализируют в отделение онкологии или реанимации (в зависимости от тяжести состояния и выраженности нарушений). При тошноте и рвоте назначают противорвотные средства. При запорах применяют слабительные и клизмы. При аритмии используют антиаритмические препараты. Для коррекции водно-солевых и кислотно-щелочных нарушений больным с синдромом распада опухоли проводят инфузионную терапию. Осуществляют контроль диуреза и коррекцию питьевого режима. В тяжелых случаях пациентов направляют на гемодиализ. При необходимости назначают анальгетики и противовоспалительные средства.
Прогноз и профилактика
При своевременном начале лечения прогноз при синдроме распада опухоли обычно благоприятный. После коррекции метаболических нарушений наблюдается восстановление функции почек. При отсутствии либо позднем начале терапии синдрома распада опухоли возможен летальный исход вследствие острой почечной недостаточности, остановки сердца или осложнений, обусловленных распадом новообразования (внутреннего кровотечения, перитонита вследствие перфорации стенки полого органа либо тяжелых инфекционных осложнений).
Меры по предотвращению развития синдрома распада опухоли включают в себя обильное питье за 1-2 дня до начала приема химиопрепаратов, а также регулярный контроль уровня креатинина, мочевой кислоты, фосфатов и кальция в сыворотке крови. В первую неделю лечения анализы осуществляют ежедневно. При появлении клинических или лабораторных признаков синдрома распада опухоли лабораторные тесты проводят несколько раз в день.
Синдром лизиса опухоли
Что такое синдром лизиса опухоли?
Чаще всего синдром лизиса опухоли развивается у пациентов с неходжкинскими лимфомами или лейкозами. Однако он может встречаться при лечении любой быстрорастущей злокачественной опухоли. Если после начала лечения рака развивается синдром лизиса опухоли, это происходит, как правило, в течение 1–3 дней. У некоторых пациентов подобные метаболические нарушения могут наблюдаться даже до начала лечения ввиду быстрого обновления раковых клеток. Состояние может быстро прогрессировать и требует немедленного медицинского вмешательства. Для отслеживания и лечения метаболических нарушений прежде, чем они станут проблемой или спровоцируют физические симптомы, проводят частые анализы крови.
Пациенты с определенными онкологическими заболеваниями, такими как лимфома Беркитта, острый лимфобластный лейкоз (ОЛЛ), острый миелоидный лейкоз (ОМЛ), или с другими факторами риска находятся под пристальным наблюдением в течение первой фазы лечения. Профилактическое лечение может включать инфузионную терапию для поддержания баланса жидкостей и назначение таких лекарственных препаратов, как расбуриказа или аллопуринол, позволяющих устранить избыток мочевой кислоты и лантана, а также гидроксид алюминия (Амфожель®) для нормализации уровня фосфора.
Диагностика синдрома лизиса опухоли
Синдром лизиса опухоли может привести к необратимому повреждению органов или даже внезапной смерти, поэтому врачи будут тщательно следить за состоянием детей из группы высокого риска.
Диагностика синдрома лизиса опухоли проводится на основании анализов крови. Врачи оценивают ряд отклонений, в том числе:
Симптомы синдрома лизиса опухоли
Симптомы синдрома лизиса опухоли обусловлены метаболическими нарушениями в организме. Дети с высоким риском развития синдрома лизиса опухоли должны находиться под тщательным наблюдением. В большинстве случаев метаболические нарушения корректируют еще до развития симптомов. Тем не менее, синдром лизиса опухоли может характеризоваться следующими симптомами:
Многие из этих симптомов могут быть также побочными эффектами химиотерапии или иметь другие причины.
| Метаболическое нарушение | Влияние на организм |
|---|---|
| Высокий уровень калия (гиперкалиемия) | Нарушения в работе сердца, проблемы с мышцами, повышенная утомляемость, остановка сердца, внезапная смерть |
| Высокий уровень мочевой кислоты (гиперурикемия) | Повреждение почек, почечная недостаточность |
| Высокий уровень фосфатов (гиперфосфатемия) | Повреждение почек, мышечные судороги, проблемы с сердцем |
| Низкий уровень кальция (гипокальцемия) | Тошнота, рвота, мышечные судороги, проблемы с сердцем, спутанное сознание |
Факторы риска развития синдрома лизиса опухоли
Чаще всего синдром лизиса опухоли у детей встречается при таких онкологических заболеваниях, как лейкоз или лимфома Беркитта, острый лимфобластный лейкоз (ОЛЛ) и хронический миелоидный лейкоз (ХМЛ).
Выделяют следующие факторы риска развития синдрома лизиса опухоли:
Врачи оценивают опухолевую нагрузку с учетом размера опухоли, количества лейкоцитов, уровня лактатдегидрогеназы (ЛДГ) и вовлечения костного мозга.
Кроме того, риск повышается при наличии определенных особенностей организма пациента. К ним относятся:
Синдром лизиса опухоли чаще всего развивается в ответ на интенсивную терапию рака. Виды лечения, которые ассоциируются с развитием синдрома:
Профилактика и лечение синдрома лизиса опухоли
Врачи могут проводить мероприятия, направленные на профилактику синдрома лизиса опухоли и лечение развивающихся метаболических нарушений. С целью профилактики у детей с высоким риском применяются инфузионная терапия для поддержания баланса жидкостей и различные лекарственные препараты. Некоторым пациентам перед началом агрессивной терапии на короткое время может быть назначена менее интенсивная химиотерапия, чтобы лизис опухоли происходил медленнее. Это позволяет упростить его лечение, помочь организму поддерживать химический баланс и предотвратить повреждение почек. Ведение синдрома лизиса опухоли включает контроль результатов анализов крови, лечение конкретных метаболических нарушений и поддержку работы почек.
Контроль результатов лабораторных анализов и симптомов
Необходимо тщательно отслеживать состояние пациентов с высоким риском развития синдрома лизиса опухоли, особенно на первой неделе лечения. Своевременная медицинская помощь может снизить токсическое воздействие на организм.
Мониторинг синдрома лизиса опухоли должен включать следующее:
План наблюдения зависит от того, относится ли пациент к группе высокого, промежуточного или низкого риска.
Инфузионная терапия для поддержания баланса жидкостей
Лекарственные препараты для снижения уровня мочевой кислоты
К лекарственным препаратам для лечения повышенного уровня мочевой кислоты (гиперурикемии) при синдроме лизиса опухоли у детей относятся аллопуринол и расбуриказа.
Аллопуринол предотвращает образование мочевой кислоты. Как правило, пациенты принимают аллопуринол за 2–3 дня до начала химиотерапии и продолжают прием в течение 10–14 дней. Этот лекарственный препарат в основном используется для профилактики.
Лекарственные препараты для снижения концентрации фосфатов
Для снижения концентрации фосфатов в крови могут назначаться определенные лекарственные препараты. Эти т. н. фосфат-связывающие препараты соединяются с фосфатной группой и препятствуют ее всасыванию из пищеварительного тракта. Примерами таких лекарственных препаратов служат лантан и гидроксид алюминия (Амфожель®).
Лечение электролитного дисбаланса
Электролитный дисбаланс (повышение уровней калия и фосфатов и снижение уровня кальция) зачастую может устраняться путем поддержания работы почек. Однако эти нарушения могут представлять непосредственную угрозу для пациента и требовать специфического лечения. Важнейшее значение имеет адекватное восполнение потери жидкости. Во время лечения синдрома лизиса опухоли следует исключить некоторые электролиты из растворов для инфузионной терапии.
Диализ
Синдром лизиса опухоли встречается редко. Тем не менее, он может стать причиной серьезных заболеваний. Пациенты из группы риска подлежат тщательному наблюдению для устранения метаболических нарушений. Важно соблюдать рекомендации по питьевому режиму, диете и приему лекарственных препаратов. Ваш лечащий врач может подробно рассказать о синдроме лизиса опухоли и сообщить, относится ли ваш ребенок к группе риска. Всегда сообщайте врачам о каких-либо проблемах со здоровьем и об изменениях симптомов во время или после лечения.
—
Онлайн-ресурс Together не является рекламой каких-либо из фирменных продуктов, упомянутых в этой статье.
Синдром лизиса опухоли
Синдром распада опухоли (СРО) — это состояние, которое развивается при распаде большого количества опухолевых клеток за короткий период времени с высвобождением клеточного содержимого в кровь.
Как СРО влияет на организм?
При быстром распаде клеток опухоли концентрации мочевой кислоты, калия и фосфора в крови возрастают быстрее, чем почки могут удалить данные вещества. Это вызывает СРО. Избыточный фосфор способен «удерживать» кальций, что снижает его уровень в крови. Изменения концентрации мочевой кислоты, калия, фосфора и кальция в крови могут влиять на работу внутренних органов: сердца, головного мозга, мышц, желудочно-кишечного тракта и особенно почек.
Что способствует СРО?
Не у всех онкобольных одинаковый риск развития СРО. Он встречается чаще у пациентов с массивными опухолями и/или опухолями, которые могут характеризоваться очень высокой скоростью деления клеток, например, такими как острая лейкемия или высокодифференцированная лимфома. Еще один фактор риска СРО — хороший ответ опухоли на терапию. СРО может возникать спонтанно (до начала терапии), однако чаще всего данный синдром инициируется в течение первой недели после начала лечения. СРО не ограничивается пациентами, получающими традиционную химиотерапию: он может также возникать у тех, кто принимает стероиды, гормоны, таргетную или лучевую терапию. Обезвоженные пациенты с уже существующей почечной дисфункцией находятся в группе высокого риска возникновения СРО.
Каковы симптомы СРО и как его диагностировать?
Как правило, симптомы не являются специфичными. К ним относятся:
Диагностика СРО основывается на сопоставлении результатов анализа крови и симптомов. Его начало может быть подострым, при этом заподозрить развитие синдрома можно лишь по нескольким лабораторным отклонениям, однако данное состояние может также дебютировать с явной клинической картиной почечной и полиорганной недостаточности.
Можно ли предотвратить СРО?
Некоторые меры могут снизить шансы развития СРО. Лечащему врачу стоит тщательно изучить результаты анализов крови и характеристики опухоли, чтобы определить риск развития СРО у пациента и оценить, какие профилактические меры можно использовать. Внутривенные вливания могут помочь почкам вымыть токсины в мочу. Для снижения уровня мочевой кислоты могут быть назначены такие препараты, как Аллопуринол и Расбуриказа.
Как лечить СРО?
Даже с применением превентивных мер сохраняется риск развития СРО. Пациенты с высоким риском СРО должны находиться под более тщательным лабораторным и клиническим мониторингом до и во время терапии, чтобы обеспечить раннюю диагностику СРО, если он начнет развиваться. Лечение аналогично профилактическим мерам, включая внутривенные вливания, Аллопуринол и особенно Расбуриказу. Пациентам может потребоваться перенаправление в отделение интенсивной терапии. Анализы крови и мочи, оценка сердечного ритма — должны повторяться часто, чтобы оценить уровни электролитов и маркеров повреждения почек. Необходима тщательная коррекция электролитных нарушений. Некоторым пациентам с тяжелыми повреждениями почек может временно потребоваться гемодиализ.
Синдром острого лизиса опухоли (обзор)
Сокращения:
СОЛО – синдром острого лизиса опухоли;
ХТ – химиотерапия;
ЛТ – лучевая терапия;
ОПП – острое повреждение почек;
ОПН – острая почечная недостаточность;
ОЛЛ – острый лимфобластный лейкоз;
ОМЛ – острый миелоидный лейкоз;
АТФ – аденозинтрифосфорная кислота.
Синдром острого лизиса опухоли (СОЛО) описывается как ряд метаболических нарушений, возникающих из-за разрушения опухоли. Разрушение опухолевых клеток может начаться спонтанно (редко), после проведенной хирургической операции или после длительной гипертермии, а также (часто) может сопровождать цитотоксическую терапию. Разрушение большого количества злокачественных клеток приводит к высвобождению внутриклеточных ионов калия, фосфора, а также белков, нуклеиновых кислот и их метаболитов во внеклеточное пространство. Попадая в большом количестве в системный кровоток, эти вещества вызывают угрожающие жизни нарушения обмена веществ и электролитов.
В гуманной медицине основными опухолевыми заболеваниями, вызывающими быстрый распад большого количества злокачественных клеток, являются лимфосаркомы, ОЛЛ, ОМЛ, миеломы и некоторые солидные новообразования, такие как карциномы яичка и молочной железы, мелкоклеточные карциномы легкого. У животных описаны случаи развития СОЛО при наличии лимфопролиферативных неоплазиях, карцином молочной железы (МЖ), мезотелиом.
Патофизиология
А – схема метаболизма белков после распада опухолевых клеток у кошек и собак.
Б – схема метаболизма белков у собак с недостаточностью фермента уриказы, в том числе и с мутацией в гене SLC2A9.
Поскольку у домашних животных (кошек и собак) синдром острого лизиса опухоли встречается достаточно редко, его следует дифференцировать от токсических осложнений ХТ, таких как различные анафилактические реакции, гибель нормальных тканей организма (эпителия кишечника и клеток костного мозга), сепсиса (ССВО), ОПН вследствие токсического действия цитостатических препаратов (доксорубицин, препараты платины, метотрексат). Следует помнить, что повреждение почек может развиваться на фоне применения нефротоксичных химиотерапевтических агентов, а гиперфосфатемия и гиперкалиемия вторичны по отношению к ОПП, тогда как при наличии СОЛО гиперфосфатемия и гиперкалиемия являются причинами возникновения ОПП.
Основные лабораторные нарушения: гиперфосфатемия, гипокальциемия, гиперкалиемия, азотемия, метаболический ацидоз.
Основные клинические симптомы:
нарушения сердечно-сосудистой системы: аритмии;
нарушения ЖКТ: рвота, диарея, тошнота, анорексия;
нарушения нервной системы: тетания, судороги, слабость, потеря сознания, парестезии;
нарушения мочевыделительной системы: анурия, олигурия на фоне ОПП.
Важно также помнить, что у пациентов с наличием СОЛО повышается риск внезапной смерти!
Профилактика и лечение
Для животных профилактика данного синдрома не разработана, это связано с низкой частотой его встречаемости и отличиями в патогенезе по сравнению с людьми. В гуманной медицине при наличии у пациентов опухолей с высоким риском быстрого распада перед проведением ХТ используют препарат «Аллопуринол», который предотвращает образование мочевой кислоты, но не устраняет ее в тех случаях, когда она уже сформировалась.
Актуальность данного профилактического мероприятия у животных является спорной*.
Выводы
Несмотря на то что данный синдром является редким осложнением ХТ, клиницистам следует помнить о нем. Важно учитывать возможные триггеры и понимать патогенез для своевременной диагностики и лечения. Не менее важно дифференцировать СОЛО от других токсических эффектов химиотерапии.
СОЛО – синдром, развивающийся на фоне гибели большого количества злокачественных клеток, таким образом, любая объемная злокачественная масса, хорошо поддающаяся цитотоксической терапии, может стать причиной развития СОЛО. Если отсутствуют электролитные нарушения и уменьшение объема опухолевой массы, то причиной ухудшения состояния пациентов не может быть СОЛО.
Следует помнить, что животные с хроническими заболеваниями почек, печени, а также собаки с мутацией в гене SLC2A9 имеют повышенные риски развития синдрома острого лизиса опухоли за счет более высоких значений мочевой кислоты в системном кровотоке.
Примечания
*У кошек есть породная предрасположенность к схожим мутациям, однако пока в этой области не проводилось достаточного количества исследований, результаты которых позволили бы прийти к единому мнению. К группе риска относят представителей следующих пород: сиамская, египетская мау и бирманская.
**У далматинцев, английских бульдогов и русских черных терьеров встречается мутация, результатом которой является замедление процесса превращения мочевой кислоты в аллантоин, а также реабсорбция мочевой кислоты проксимальными почечными канальцами. Это приводит к возникновению гиперурикемии и гиперурикозурии (400–600 мг мочевой кислоты в день), что может привести к механизмам развития СОЛО, схожим с таковыми у человека7,9.