Синдром линча что это
Синдром линча что это
Внимание: несмотря на «неполипозный» характер, рак развивается из полиповидных предшественников, но в отличие от САТК число полипов значительно меньше.
б) Симптомы. Развитие колоректального рака (КРР) (и сопутствующих опухолей) в молодом возрасте. Симптомы отсутствуют или не отличаются от симптомов спорадического колоректального рака (КРР).
в) Дифференциальный диагноз наследственного неполипозного рака толстой кишки (ННПРТК):
• Другие варианты наследственного рака: САТК, МАП.
• Семейный КРР без идентификации мутантного гена.
• Макроскопическое исследование: ограниченное число полипов (часто плоских), в основном, в правых отделах (т.е. проксимальнее селезеночного изгиба).
• Микроскопическое исследование: обычно малодифференцированная аденокарцинома с медуллярным ростом, перстневидноклеточным и слизистым строением.
Микросателлитная нестабильность (MSI): 90-95% опухолей при ННПРТК MSI+, высокая частота MSI (изменения в двух и более из пяти панелей) по сравнению с 15-20% MSI+ при спорадическом КРР.
д) Обследование при наследственном неполипозном раке толстой кишки (ННПРТК)
Необходимый минимальный стандарт:
• Выявление/лечение членов семьи с риском развития ННПРТК (у всех больных): запись в истории болезни о консультации и информировании пациента относительно данного заболевания (внимание: возможность судебного иска!)
Пациенты без симптомов/члены семьи при наличии семейного анамнеза:
• Семейный анамнез, генетическая консультация/тестирование (если не выполнено).
• Ежегодные колоноскопии, начиная с 25-летнего возраста (не позднее 10-15 лет с момента выявления рака у наиболее молодого члена семьи).
• Женщины: ежегодное исследование аспирата эндометрия.
• Скрининг других внекишечных опухолей: четкие рекомендации отсутствуют => в зависимости от семейных особенностей. При наличии рака, полипа с высокой степенью дисплазии или при увеличивающемся числе полипов => операция.
Больные колоректальным раком (КРР) моложе 50 лет:
• Семейный анамнез: Амстердамские критерии? Семья не соответствует критериям, если доказанность ННПРТК около 50%.
• Генетическое тестирование: критерии Бетезда?
• Идентификация/лечение членов семьи с риском развития ННПРТК: запись в истории болезни о консультации и информировании пациента относительно данного заболевания (внимание: возможность судебного иска!)
• Индивидуальная программа обследования для выявления КРР до операции.
ж) Лечение без операции наследственного неполипозного рака толстой кишки (ННПРТК):
• Химиопрофилактика: роль не определена.
• Ежегодные колоноскопии и полипэктомии.
• В зависимости от стадии опухоли: адъювантная химиотерапия (рак толстой кишки), или (нео-) адъювантная химиолучевая терапия (рак прямой кишки).
з) Операция при наследственном неполипозном раке толстой кишки (ННПРТК)
Показания:
• Любой рак, прогрессирующая аденома (большой размер или дисплазия высокой степени) либо увеличение числа полипов, за исключением случаев множественных метастазов или абсолютных противопоказаний.
Хирургический подход:
• Субтотальная резекция ободочной кишки (лечебная + профилактическая): рекомендована при всех опухолях, расположенных проксимальнее сигмовидной кишки, за исключением случаев отказа больного или наличия противопоказаний к операции, связанной со значительным укорочением толстой кишки.
• Сегментарная колоректальная резекция: только с лечебной целью в соответствии с онкологическими принципами.
• Рак прямой кишки при ННПРТК: низкая передняя резекция (с/без неоадъювантной химиолучевой терапии), профилактическая проктоколэктомия обычно не рекомендуется из-за полной утраты функции прямой кишки.
• Женщины (в частности, при наличии семейного анамнеза рака матки или мутации в hMSH6 или в hMLHl и hMSH2): обсуждение вопроса о гистерэктомии/овариоэктомии (в пострепродуктивном периоде, при наступлении менопаузы или во время других абдоминальных вмешательств).
и) Результаты. Несмотря на худшие патоморфологические признаки при ННПРТК, влияние микросателлитной нестабильности (MSI) на ответ при химиотерапии по сравнению со спорадическим колоректальным раком (КРР) при сопоставлении в соответствии со стадией, все еще дискутабельно.
к) Наблюдение. Непрерывное ежегодное наблюдение/скрининг колоректального рака (КРР) и внекишечных опухолей => ежегодная полная колоноскопия, сигмоидоскопия (после операции), исследование аспирата эндометрия.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Синдром Линча
Синдром Линча – наследственное заболевание, сопровождающееся развитием злокачественных новообразований в толстом кишечнике. Клинические проявления аналогичны другим видам колоректального рака. Отличительными особенностями являются раннее начало, высокая частота первично-множественных опухолей и преимущественное поражение правых отделов толстого кишечника. При синдроме Линча-II колоректальный рак сочетается с внекишечными злокачественными неоплазиями. Диагноз выставляется с учетом семейного анамнеза, иммуногистохимических тестов, колоноскопии, ирригоскопии, биопсии и других исследований. Лечение – операции, химиотерапия.
Общие сведения
Синдром Линча (наследственный неполипозный колоректальный рак) – генетически обусловленное заболевание, при котором наблюдается развитие злокачественных опухолей толстого кишечника. Передается по аутосомно-доминантному типу. Составляет около 3% от общего количества случаев колоректального рака. В 30% случаев при синдроме Линча отмечается возникновение синхронных или метахронных неоплазий. В ряде случаев новообразования толстой кишки сочетаются с онкологическими поражениями яичников, матки, мочевого пузыря, почечной лоханки, мочеточника, желудка, желчных путей и тонкого кишечника.
Риск развития онкологического заболевания у больных синдромом Линча с подтвержденной генетической мутацией колеблется от 30 до 80%. Отличительной особенностью является раннее начало заболевания. Злокачественные опухоли при синдроме Линча обычно диагностируются в возрасте до 50 лет, на 10-15 лет раньше, чем в среднем по популяции. Средний возраст появления первых симптомов составляет 44 года. Около 70% неоплазий локализуются в правой половине толстого кишечника. Лечение проводят специалисты в сфере онкологии, абдоминальной хирургии и гастроэнтерологии.
Причины развития и классификация синдрома Линча
Причиной развития являются мутации генов, ответственных за ошибки репарации ДНК: PMS2, MSH6, MSH2 и MLH1. Возможно сочетание нескольких мутаций с соответствующим увеличением риска возникновения злокачественных новообразований. Выявляется аутосомно-доминантный характер наследования. Обычно у больных с синдромом Линча диагностируются слизистые аденокарциномы или перстневидно-клеточный рак. Для опухолей характерен низкий уровень дифференцировки клеток при редком метастазировании, хорошем ответе на терапию и относительно благоприятном прогнозе.
Различают два типа заболевания: синдром Линча-I и синдром Линча-II. Первый вариант протекает без внекишечных проявлений, единственным признаком заболевания является раннее развитие множественных неоплазий толстого кишечника при отсутствии предшествующего полипоза. При синдроме Линча-II наблюдается сочетание аденокарцином толстой кишки и злокачественных опухолей других локализаций. Обычно страдают внутренние женские половые органы, возможно также поражение вышележащих отделов пищеварительного тракта. Вероятность развития рака эндометрия при синдроме Линча-II составляет от 30 до 60%, риск возникновения новообразований других локализаций – 10-15%.
Симптомы синдрома Линча
До появления злокачественных опухолей толстого кишечника симптоматика отсутствует. При развитии неоплазий клинические проявления соответствуют ненаследственному колоректальному раку. Наблюдаются боли, нарушения аппетита, расстройства стула, слабость и анемия. Из-за высокого расположения новообразований кровь в кале при синдроме Линча визуально обычно не определяется. Выраженность и характер болевого синдрома существенно варьируют. Обычно пациенты жалуются на ноющие либо тянущие боли слабой или средней интенсивности. Реже у больных синдромом Линча возникает кратковременная приступообразная боль, напоминающая боли при остром холецистите или остром аппендиците.
При пальпации достаточно крупных опухолей определяются малоподвижные узлы плотно- или мягкоэластической консистенции. При прогрессировании злокачественного новообразования у больных синдромом Линча выявляются симптомы интоксикации, возникшие из-за распада неоплазии, и явления кишечной непроходимости, обусловленные препятствием прохождению каловых масс по кишечнику. При отдаленном метастазировании наблюдаются нарушения функций соответствующих органов. Отмечаются выраженная слабость, эмоциональная лабильность, склонность к депрессиям, повышение температуры и прогрессирующее истощение.
Симптомы опухолей других локализаций при синдроме Линча также соответствуют ненаследственным формам онкологических поражений тех или иных органов. Рак эндометрия и рак яичников на начальных стадиях могут протекать бессимптомно. В последующем при раке эндометрия наблюдаются боли, кровянистые, серозные или серозно-сукровичные выделения. При распространении новообразования на соседние органы возникают расстройства дефекации и мочеиспускания. Для рака яичников характерны ощущение дискомфорта, увеличение живота, нарушения менструального цикла и т. д.
Диагностика синдрома Линча
До появления злокачественных новообразований синдром Линча диагностируют на основании семейной истории и данных генетических исследований. Из-за незначительной распространенности в популяции проведение всеобщих скрининговых обследований считается нецелесообразным, генетические анализы выполняют только при выявлении соответствующего семейного анамнеза. Анамнестическими критериями синдрома Линча являются наличие гистологически подтвержденных карцином толстого кишечника у трех или более близких родственников, являющихся представителями двух или более поколений, а также один или несколько случаев начала заболевания в возрасте младше 50 лет.
Для обнаружения характерных для синдрома Линча генетических мутаций используют иммуноферментные исследования и тест на микросателлитную нестабильность. При появлении клинических признаков заболевания пациентов с синдромом Линча направляют на ирригоскопию и колоноскопию. Выполняют анализ кала на скрытую кровь. Осуществляют УЗИ, КТ или МРТ брюшной полости. План обследования больных синдромом Линча с подозрением на злокачественные опухоли женских половых органов и верхних отделов ЖКТ составляют с учетом установленных стандартов для неоплазий соответствующих локализаций. Перечень исследований при подозрении на отдаленное метастазирование определяют с учетом предположительного расположения вторичных очагов.
Лечение и профилактика при синдроме Линча
Всех пациентов с подтвержденной наследственной мутацией рассматривают, как представителей группы риска. Больным с синдромом Линча необходимо пожизненное диспансерное наблюдение, включающее в себя регулярные осмотры онколога и гастроэнтеролога, проведение колоноскопии 1 раз в 1-2 года, начиная с 25 лет, фиброгастродуоденоскопии и УЗИ брюшной полости – 1 раз в 1-2 года, начиная с 30 лет. Женщинам с синдромом Линча проводят регулярные гинекологические осмотры. Инструментальные обследования назначают 1 раз в 1-2 года, начиная с 30 лет.
При возникновении злокачественной опухоли толстого кишечника предпочтительным вариантом для больных синдромом Линча является субтотальная колэктомия. Это хирургическое вмешательство позволяет увеличить продолжительность жизни и обеспечивает более благоприятный прогноз по сравнению с частичной резекцией толстой кишки. Учитывая влияние удаления значительной части толстого кишечника на качество жизни пациентов, решение о проведении подобной операции принимают после подробного разъяснения последствий вмешательства. Вопрос о целесообразности химиотерапии при синдроме Линча пока остается дискутабельным, хотя некоторые исследователи указывают на достаточно высокую эффективность иринотекана.
Синдром Линча
(Наследственная неполипозная колоректальная карцинома; ННПКРК)
, MD, Fox Chase Cancer Center, Temple University
Симптомы и признаки синдрома Линча
Симптомы и признаки синдром Линча сходны с таковыми при других формах колоректальный рак, применяются те же принципы диагностики и лечения опухоли.
Диагностика синдрома Линча
Подробный семейный анамнез
Клинические критерии сопровождаемые исследованием на микросателлитную нестабильность (МСН) или иммуногистохимией (ИГХ)
Генетическое исследование для подтверждения диагноза
(См. также Диагностика и терапия синдрома Линча 2015 г [2015 diagnosis and management of Lynch syndrome] и Клиническое руководство по генетическому тестированию и лечению наследственных синдромов рака желудочно-кишечного тракта Американской коллегии гастроэнтерологов [American College of Gastroenterology’s clinical guideline on the genetic testing and management of hereditary GI cancer syndromes.)
Специфический диагноз синдрома Линча подтверждают генетическим тестированием. Тем не менее сложно определить, кому проводить тестирование, поскольку, в отличие от семейного аденоматозного полипоза, нет типичной фенотипической картины. Таким образом, при подозрении на синдром Линча подробный семейный анамнез должен быть собран у всех пациентов молодого возраста с колоректальным раком (КРР).
Для установления соответствия Амстердамским критериям II диагностики синдрома Линча необходимо наличие всех трех из описанных признаков:
Три или более родственника с КРР или раком, ассоциированным с синдромом Линча
КРР отмечается по крайней мере в двух поколениях;
по крайней мере в одном случае КРР развился в возрасте
Пациентам, отвечающим этим критериям, необходимо провести анализ опухолевых тканей или на микросателлитную нестабильность или с помощью иммуногистохимических методов определить протеины, которые отвечают за репарацию ошибок репликации ДНК; впрочем, большинство коммерческих и госпитальных патологоанатомических лабораторий в настоящее время, в рабочем порядке, выполняют этот анализ на всех образцах колоректальной аденокарциномы. Руководство American Gastroenterological Association 2015 года рекомендуют проводить иммуногистохимические исследования и тест на микросателитную недостаточность пациентам с опухолями. Показано генетическое тестирование на наличие генетических мутаций, специфичных для синдрома Линча, если результаты ИГС (иммуногистохимических) исследований или анализ на МСН (микросателитную недостаточность) были положительными.
Пациентам с синдромом Линча должна проводиться контрольная колоноскопия каждые 1-2 года. Пациенты с подтвержденным синдромом Линча нуждаются в непрерывном скрининге на предмет рака других органов. Для выявления рака эндометрия рекомендуется ежегодно проводить аспирацию эндометрия или трансвагинальное УЗИ. Для выявления рака яичников следует ежегодно проводить трансвагинальное УЗИ и исследование уровня СА-125 в сыворотке. Также может рассматриваться профилактическое удаление матки с придатками. Для скрининга рака почки можно применять общий анализ мочи.
Родственникам пациентов с синдромом Линча 1-й степени родства необходимо провести генетическое тестирование. В случае, если генетическое тестирование не было проведено, им необходимо проводить колоноскопию каждые 1–2 года, начиная с 20 лет, а в возрасте старше 40 лет – ежегодно. Родных 1-й степени родства женского пола необходимо ежегодно обследовать на рак эндометрия и яичников.
Справочные материалы по диагностике
1. Umar A, Boland CR, Terdiman JP, et alUmar A, Boland CR, Terdiman JP, et al: Revised Bethesda guidelines for hereditary nonpolyposis colorectal cancer (Lynch syndrome) and microsatellite instability. J Natl Cancer Inst 96(4):261–268, 2004. doi: 10.1093/jnci/djh034
Лечение синдрома Линча
Наиболее распространенным лечением синдрома Линча является резекция наибольшего пораженного опухолью участка с частым наблюдением на предмет развития другого вида рака толстой кишки и любых ассоциированных опухолей других органов. Поскольку большинство опухолей при синдроме Линча развиваются проксимальнее селезеночного изгиба, как один из методов хирургического лечения проводится субтотальная колэктомия с сохранением ректосигмоидного отдела. В любом случае необходимо тщательное наблюдение пациента.
Ключевые моменты относительно синдрома Линча
Определенные аутосомные доминантные генетические мутации несут 70–80% – риск развития колоректального (КРР) в течение жизни.
У таких пациентов также повышен риск развития других опухолей, особенно рака эндометрия и яичников.
Клинические проявления, принципы диагностики и лечения сходны с таковыми для других форм колоректального рака.
В случаях, соответствующих определенным критериям наследственной отягощенности, следует исследовать ткань опухоли на микросателлитную нестабильность (МСН) или провести иммунохимический анализ; при позитивном результате проводится генетическое тестирование.
Родным пациентов с ННПКРР 1-й степени родства, которым не было проведено генетическое тестирование, необходимо проводить колоноскопию каждые 1–2 года, начиная с 3-ей декады жизни, а в возрасте старше 40 лет – ежегодно. Женщин необходимо ежегодно обследовать на рак эндометрия и яичников.
Дополнительная информация о синдроме Линча
Ниже следуют некоторые англоязычные ресурсы, которые могут быть информативными. Обратите внимание, что The manual не несет ответственности за содержание этих ресурсов.
PREMM5: Prediction model for MLH1, MSH2, MSH6, PMS2, and EPCAM gene mutations
Генетический ландшафт синдрома Линча
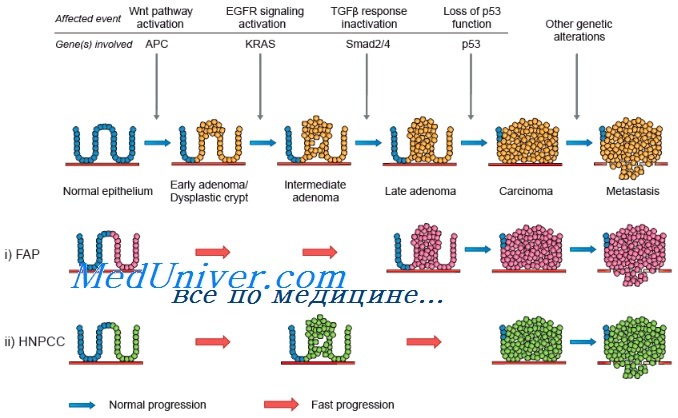
Наследственные опухолевые синдромы характеризуются наличием генетического дефекта, приводящего к крайне высокому риску развития неоплазий определенных локализаций. Ранний возраст возникновения опухолей и особые фенотипические признаки, определяющие возможности терапии и прогноз, обусловливают важность включения в программу обследования пациентов консультации врача-генетика (онкогенетика), который определит необходимость проведения высокоспецифичных (а также относительно дорогостоящих) молекулярно-генетических исследований с анализом нуклеиновых кислот и выявлением герминальных мутаций в определенных генах.
От 20 до 30 % случаев колоректального рака (КРР) предположительно связаны с генетическими факторами, а 3–5 % этой патологии представлены наследственными формами КРР с идентифицированной генетической составляющей [1].
Синдром Линча (СЛ) — наиболее распространенная форма наследственного КРР (2–4 % всех случаев КРР). При наличии этого синдрома риск развития КРР составляет 20–70 % при относительно раннем возрасте постановки первичного диагноза (от 44 до 61 года, наиболее часто в период с 40 до 45 лет, при этом у больных со спорадическими формами КРР средний возраст развития заболевания около 69 лет) [2].
Это аутосомно-доминантное наследственное заболевание, основа которого — герминальная мутация в генах системы репарации ошибочно спаренных оснований ДНК (МisМatch Repair, MMR). Функция этой системы — исправление ошибок между некомплементарными основаниями при скольжении ДНК-полимеразы в период репликации [3].
СЛ долгое время характеризовался как наследственный неполипозный колоректальный рак (HНКРР). Это название отражало морфологическое отличие от другой формы наследственного КРР — семейного аденоматозного полипоза, важным признаком которого является обнаружение от 100 до 1000 полипов. Но все же термин ННКРР не совсем корректен, так как у больных СЛ отмечается возникновение от одного до нескольких аденоматозных полипов толстой кишки, а также злокачественные новообразования других локализаций: рак эндометрия (риск возникновения от 50 до 71% при среднем возрасте первичной диагностики 48–62 лет), почечных лоханок, мочевого пузыря, мочеточника, яичников (риск 4–12 % при среднем возрасте первичной диагностики 42,5 лет), желудка (риск развития 6–13 % при среднем возрасте первичной диагностики 56 лет), тонкой кишки, а также опухоли головного мозга, сальных желез. Выделение синдромов Линча I (наличие в семье пациента только случаев рака толстой кишки) и II (ранний возраст развития рака преимущественно в проксимальных отделах толстой кишки у пациента и данные о наличии в его семье случаев злокачественных новообразований внекишечной локализации) в настоящее время не актуально, так как вероятность возникновения опухолей различной локализации присутствует у любого пациента с СЛ [2].
Описаны различные варианты СЛ. Например, синдром Мюир-Торре, также имеющий аутосомно-доминантный тип наследования и мутации в генах MMR. Помимо неполипозного КРР, при этом заболевании отмечено возникновение аденом сальных желез, эпителиом и карцином кожи, множественных кератоакантом; известны случаи развития рака тела матки, рака органов мочевыделительной системы, верхних отделов желудочно-кишечного тракта. Один из двух типов синдрома Тюрко характеризуется наличием у пациента СЛ в сочетании с глиальными опухолями головного мозга (в основном глиобластомами) [4].
Неоднозначны представления о рисках развития рака молочной железы, поджелудочной железы [5] и простаты [6].
Помимо раннего возраста возникновения опухолей, другими фенотипическими особенностями злокачественных новообразований при СЛ являются локализация в правой ободочной кишке, наличие множественных синхронных и метахронных опухолей, низкая степень дифференцировки (перстневидноклеточные и слизистые гистологические типы рака), выраженная лимфоцитарная перитуморальная воспалительная инфильтрация, напоминающая гистологические признаки так называемой «реакции Крона», наличие микросателлитной нестабильности [4].
Повреждения в системе репарации ДНК выключают онкосупрессорную активность этой системы. В подавляющем большинстве случаев аберрации при СЛ затрагивают ген MLH1 (mutL homolog 1), расположенный на третьей хромосоме на участке 3p21, ген MSH2 (mutS homolog 2) — вторая хромосома, участок 2p16 — у 71 % и 84 % пациентов с СЛ соответственно. Эти два гена считаются мажорными для СЛ. Также повреждаются и другие гены, которые называют минорными. К ним относят ген MSH6 (mutS homolog 6: вторая хромосома, участок 2p16), ген PMS2 (postmeiotic segregation increased 2, расположенный на седьмой хромосоме в регионе 7p22), ген MLH3 (mutL homolog 3, на второй хромосоме в регионе 2p16) и ген MSH3 (mutS homolog 3, на пятой хромосоме на участке 5q11) [7].
Белки, кодируемые этими генами, обеспечивают «работу над ошибками» во время скольжения по молекуле ДНК. Если в период репликация ДНК возникало нарушение последовательности нуклеотидов (небольшие инсерции или делеции), ее обнаруживает гетеродимерный комплекс белков MSH2 и MSH6. После этого на место происшествия прибывает другой гетеродимер, состоящий из белков MLH1 и PMS2. И уже этот «квартет» призывает экзонуклеазы, совместно с которыми безжалостно удаляет ошибочные последовательности оснований и исправляет поврежденный участок за счет ресинтеза.
Помимо мутаций в перечисленных генах, на ход MMR может повлиять структура гена EPCAM, кодирующего молекулу клеточной адгезии на мембране клетки. Он является «соседом» гена MSH2, располагаясь перед ним на хромосоме. Выпадение (делеция) нуклеотидов на 3’ конце EPCAM приведет к гиперметилированию промотора гена MSH2, что обеспечит эпигенетический механизм его инактивации [8].
Для каждого гена описаны «излюбленные» локализации опухолей. При наличии патогенных вариантов нуклеотидной последовательности в гене MSH2 отмечают более высокую частоту возникновения экстраколонических злокачественных опухолей (у 48–61 % пациентов обнаруживается рак тела матки, желудка, яичников или почек), чем при поломках в гене MLH1 (всего около 11–42 % опухолей внекишечной локализации).
Что касается минорных генов, мутации гена MSH6 ассоциируются с более легким течением заболевания, а при аберрациях гена PMS2 отмечено развитие множественных колоректальных аденом и глиобластом. При мутациях в гене MLH3 также наблюдается возникновение опухолей головного мозга. Двуаллельные мутации в гене MSH3 вызывают полипозные формы, сходные с фенотипом семейного аденоматозного полипоза [9].
Снижение функции системы MMR определяет высокую частоту мутаций (увеличение или уменьшение количества мономеров) в коротких (от 1 до 6 нуклеотидов) повторяющихся последовательностях ДНК — микросателлитах. Это состояние описывается как микросателлитная нестабильность (МСН) и обнаруживается приблизительно в 95 % случаев всех ассоциированных с ЛС злокачественных новообразований. Высокий уровень микросателлитной нестабильности ассоциирован с более благоприятным прогнозом, но при нем отмечена низкая эффективность применения 5-фторурацила. В спорадических (ненаследственных) случаях КРР также может наблюдаться МСН, сочетающаяся с соматической мутацией в онкогене BRAF, приводящей к замене глутамата на валин в кодоне 600 (BRAF V600E) [10].
Кроме МСН, описано еще одно нарушение, ассоциированное с состоянием «нестабильности». Это так называемые «повышенные микросателлитные изменения в отдельных тетрануклеотидных повторах» (еlevated microsatellite alterations at selected tetranucleotide repeats, EMAST). Одной из известных причин EMAST является снижение экспрессии или дисфункция MSH3, активность которого в комплексе с MSH2 необходима для устранения несоответствия тетрануклеотидных повторов. Обнаружение EMAST при КРР ассоциировано с ухудшением прогноза: снижение безрецидивной выживаемости пациентов, высокая вероятность возникновения отдаленных метастазов. В опухолевой ткани с этим феноменом при гистологическом исследовании обнаружены выраженные признаки воспаления с высокой плотностью CD8+ T-клеток в воспалительном инфильтрате.
Дефектный MSH3 также ассоциирован с нарушением гомологичной репарации, что может обеспечить чувствительность таких опухолей к использованию препаратов, усугубляющих репаративные возможности опухолевых клеток, что приводит к их гибели. К таким препаратам относятся, например, ингибиторы поли-АДФ-рибоза-полимеразы 1 (PARP1) (олапариб) [11].
Выявление характерных мутаций позволяет не только установить диагноз СЛ и обеспечить эффективную стратегию раннего наблюдения пациентов, но и определить пути таргетной терапии с учетом конкретного поврежденного гена, патологического варианта его нуклеотидной последовательности и изменений, вызванных нарушением его функции.