Синдром кушинга у собак чем грозит
Синдром Кушинга у собак
Синдром Кушинга (гиперадренокортицизм) – это распространенное гормональное расстройство у собак, возникающее вследствие чрезмерной выработки и избыточного количества кортизола (гормона стресса) в организме животного.
В нормальном состоянии кортизол выполняет ряд важнейших функций:
Чрезмерное содержание кортизола препятствует процессам метаболизма, провоцирует расстройства ЖКТ, вызывает гипертонию и приводит к множеству других осложнений.
Читайте в этой статье:
Формы синдрома: особенности
Гиперадренокортицизм наблюдается у собак в нескольких формах, возникновение и развитие которых провоцируют различные причины.
Болезнь Кушинга
Спонтанный гиперадренокортицизм, возникающий вследствие чрезмерной выработки гормона кортизола надпочечниками. У здоровых собак это происходит в качестве ответа на сильный стресс (длительное голодание, изнурение и др.).
Обратите внимание! Эта форма заболевания Кушинга-Иценко является наиболее распространенной и диагностируется в 80-85% случаев.
Опухоль, появляющаяся в гипофизе, обычно доброкачественная. Её стандартные размеры – 2-3 мм, при этом растет она медленно. Именно по этой причине заболевание развивается не стремительно: от нескольких месяцев до нескольких лет.
Синдром Кушинга (глюкостерома)
Опухоль возникает и развивается в одном или сразу обоих надпочечниках. Следственно, выработка кортизола увеличивается в разы, что приводит к негативным последствиям для всего организма. Эта форма болезни Кушинга-Иценко диагностируется у 15-20% собак.
Обратите внимание! Ровно в половине этих случаев опухоль носит злокачественный характер и стремительно увеличивается в размерах, поэтому симптомы патологии развиваются очень быстро.
Ятрогенный синдром
Наблюдается при чрезмерном введении гормональных препаратов (например, преднизолона, дексаметазона). Обычно они назначаются для устранения воспалительных процессов, различных аллергических реакций и ряда заболеваний.
Ятрогенный синдром – это единственная форма болезни Кушинга, при которой симптомы заболевания пропадают при отмене препарата. Резкое прекращение его употребления недопустимо: требуется постепенное уменьшение суточной дозировки.
Группы риска: какие породы наиболее подвержены заболеванию?
Синдром Кушинга-Иценко может развиваться у собак абсолютно любой породы. Однако статистика показывает, что наибольшему риску подвержены:
Спонтанный гиперадренокортицизм, вызванный опухолью в гипофизе, обычно встречается у маленьких собачек, вес которых составляет не более 20 кг (75% случаев). Особую группу риска составляют кастрированные и стерилизованные животные. Они больше остальных подвержены этому заболеванию, при этом симптоматика проявляется быстрее. Между полом и развитием гиперадренокортицизма связь не установлена. Исследования по этому вопросу ведутся до сих пор, но статистика показывает: и самцы, и самки одинаково подвержены этой болезни.
В каком возрасте собаки болеют синдромом Кушинга-Иценко?
Гиперадренокортицизм в любых формах обычно наблюдается у от 8-10 лет и выше. Случаи проявления болезни у более молодых животных минимальны, как правило, у них наблюдается только ятрогенный синдром, спровоцированный приемом гормональных препаратов.
Симптоматика
Гиперадренокортицизм в 80-85% случаев развивается медленно. Синдром Кушинга оказывает негативное влияние на множество систем жизнедеятельности, поэтому симптоматика может значительно отличаться у разных собак.
Основные симптомы, свидетельствующие о развитии патологии:
Обратите внимание! Синдром Кушинга-Иценко зачастую ошибочно принимается хозяевами собак за признаки старения.
Если вы заметили у своего питомца хотя бы несколько признаков, настоятельно рекомендуем записаться на консультацию к опытному ветеринару!
Диагностика болезни Кушинга-Иценко у собак
Диагностирование гиперадренокортицизма начинается с тщательного осмотра. При выраженной симптоматике его достаточно для постановки диагноза. Следующим шагом проводятся функциональные тесты. Они базируются на введении дексаметазона и гормона АКТГ, позволяющих оценить состояние и функционирование надпочечников.
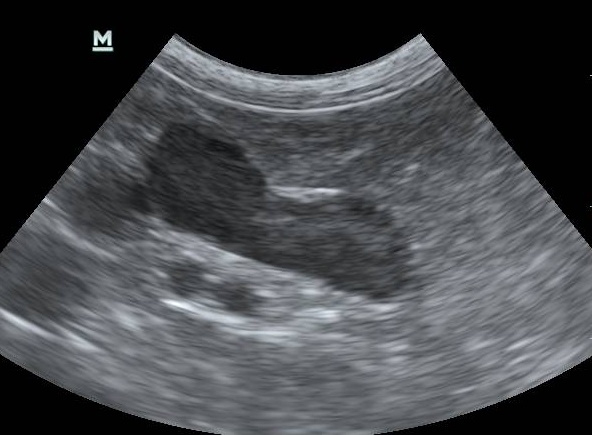
При диагностировании назначается УЗИ брюшной полости. На основании полученных результатов удастся установить наличие опухолей или увеличение надпочечников в размерах. Чтобы выявить опухоли любого характера в гипофизе либо надпочечниках, применяется МРТ либо КТ (при условии, что эти формы диагностирования доступны).
Рекомендуем регулярно обращаться в ветеринарную клинику для прохождения диагностики. Чем раньше синдром Кушинга будет диагностирован, тем эффективнее дальнейшее лечение.
Лечение болезни Кушинга-Иценко у собак
Устранение синдрома Кушинга-Иценко и его последствий возможно только при обращении к профессионалам. Под руководством опытных ветеринаров проводится хирургическое (оперативное) либо медикаментозное (консервативное лечение).
Обратите внимание! Метод лечения определяется с учетом формы гиперадренокортицизма и общего состояния собаки.
Хирургическое
При оперативной форме лечения осуществляется удаление пораженного надпочечника, после чего назначается пожизненный прием гормональных препаратов, восполняющих функции отсутствующего органа. Если опухоль развивается в гипофизе, хирургическое лечение невозможно в связи с высокими показателями смертности собак и серьезными осложнениями после вмешательства.
Лучевая терапия при синдроме Кушинга назначается редко при условии, что размеры доброкачественной или злокачественной опухоли слишком большие (1 см и более), а также при наличии различных неврологических нарушений.
Терапевтическое
При консервативном лечении назначаются медикаментозные препараты, направленные на регулирование содержания кортизола в крови.
Наиболее распространенные препараты:
Синдром Кушинга-Иценко у собак – вовсе не приговор. При своевременной диагностике и правильном лечении под контролем квалифицированных ветеринаров удастся добиться долгой жизни вашего животного без ухудшения её качества!
Синдром Кушинга у собак: вчера и сегодня
Масимов Э.Н., к.б.н., ветеринарный врач ИВЦ МВА, г.Москва
Устойчивое длительное повышение уровня кортизола в крови, сопровождаемое нарушением ряда клинических функций называется синдромом Кушинга (гиперадренокортицизм). Гиперадренокортицизм ассоциирован с излишней продукцией или экзогенным введением глюкокортикоидов, и является одной из наиболее часто диагностируемой эндокринопатией у собак.
В гуманной медицине можно встретить такое понятие как «синдром Иценко-Кушинга», «болезнь Иценко-Кушинга». Эти два определения имеют довольно четкие различия. Так, например, болезнь Иценко-Кушинга, нейроэндокринное заболевание. Синдромом Иценко-Кушинга принято обозначать новообразование надпочечника, доброкачественного или злокачественного характера.
В ветеринарной медицине, как правило, таких строгих разграничений нет. Под термином «синдром Кушинга» принято подразумевать и новообразование надпочечника, так и новообразование гипофиза, так и ятрогенную форму заболевания.
В основе гиперадренокортицизма собак лежат множественные патофизиологические нарушения, но все они сводятся к хроническому избытку кортизола в организме.
Патофизиологическая классификация причин синдрома Кушинга собак включает:
У 80-85% собак со спонтанно развившимся синдромом Кушинга имеют гиперкортицизм, зависимый от гипофиза, т.е. избыточную секрецию АКТГ гипофизом, которая вызывает двустороннюю гиперплазию коры надпочечников и повышенную концентрацию глюкокортикоидов в плазме крови. Почти у всех собак с гипофизарным гиперадренокортицизмом имеется гипофизарная аденома, чаще всего локализованная в передней доле.
Стоит также отметить, что двусторонние опухоли коры надпочечников и по литературным данным, и по личному наблюдению автора, встречаются у собак редко. В исследовании Hoerauf, Reusch в 1999г у 15 исследованных собак с синдромом Кушинга, который был вызван активными опухолями коры надпочечников, у трех собак опухоли имелись в обоих железах.
Гиперадренокортицизм встречается у собак среднего или старого возраста, с возрастным диапазоном от 2 до 16 лет и средним возрастом 7-9 лет. По данным ряда авторов, патология надпочечникового происхождения встречается у более пожилых собак, чей средний возраст 11-12 лет. Породной предрасположенности нет. Из практики автора чаще всего данное заболевание диагностируется у собак пород такса, пинчер, пудель. Половая предрасположенность также отсутствует.
Клинические признаки гиперадренокортицизма весьма разнообразны. Самый частый симптомокомплекс это полиурия/полидипсия. Полидипсия – состояние, когда потребление воды свыше 100 мл/кг веса тела в течения дня, и полиурия, определяемая как продукция мочи свыше 50 мл/кг веса тела в течение дня, наблюдаются в большинстве случаев гиперадренокортицизма.
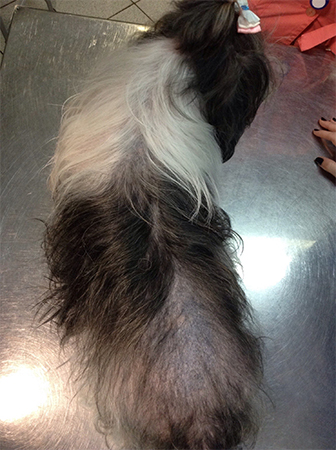
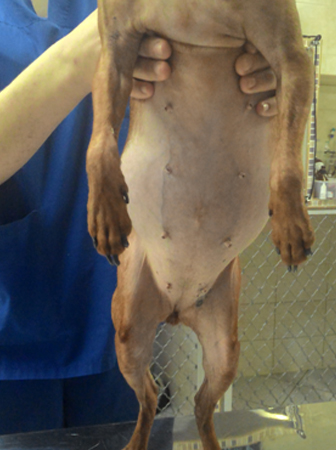
Далее, из симптомов, можно выделить полифагию, отвисший живот, алопеции, медленный рост шерсти, мышечная атрофия, одышка, у сук встречается анэструс, неврологические симптомы.
Избыточное выделение кортизола негативно влияет на один из циклов роста волоса – анаген. Происходит истончение шерстного покрова, приводящее к билатеральной симметричной алопеции. Голова, лапы и хвост обычно поражаются последними.
Гиперадренокортицизм начинается незаметно для владельцев собаки и медленно прогрессирует в течение месяцев.
На текущее время диагностика синдрома Кушинга разнообразна. Для постановки диагноза можно использовать различные лабораторные методы, визуальную диагностику, а также проводить диагностические тесты.
Ультразвуковая диагностика применима только в случае дифференциации ГАК надпочечникового происхождения от патологии гипофиза.
Рис.2 Патологический надпочечник.
Особое внимание стоит уделить гематологическим и биохимическим исследованиям крови. У собак, с предварительным диагнозом ГАК можно выделить следующие особенности лабораторных исследований.
Клинический анализ крови: нейтрофилия, лейкоцитоз, лимфопения, эозинопения. В биохимическом исследовании наблюдается повышение уровня триглицеридов и холестерина, снижение уровня мочевины, повышение щелочной фосфатазы.
Стоит уделить внимание и анализу мочи, в результатах которого отмечается снижение удельного веса.
Рис.3 Собака шитцу, 9 лет, гипофизарная форма ГАК.
Редко проводимое исследование при подозрении на ГАК – радиография. При данном исследовании отмечают признаки остеопороза, минерализации надпочечников. Адреномегалия является крайне редкой находкой при рентгенографии брюшной полости, все же большое увеличение предполагает, но не диагностирует, наличие карциномы надпочечников.
Компьютерная томография – дорогостоящий вид исследования, в последнее время все чаще применяемый для визуализации новообразования гипофиза, опухолей надпочечников, гиперплазии надпочечников.
Диагностические тесты, применяемые в практике, являются подтверждением или полным опровержением диагноза. Скрининг-тесты – АКТГ-стимулирующий тест, а также проба с низкими уровнями дексаметазона. В арсенале ветеринарного врача также имеется тест на соотношение кортизол/креатинин в моче. У всех исследований есть и свои преимущества, и свои недостатки.
Дексаметазоновая проба (проба с низкими уровнями дексаметазона) – у пациента собирают около 3 мл плазмы или сыворотки для определения концентрации кортизола; далее, вводят внутривенно дексаметазон из расчета 0,01мг/кг; далее, собирают вторую пробу для определения концентрации кортизола через 3-4 часа и третью пробу через 8 часов после введения дексаметазона.
Супрессивная проба низкими дозами дексаметазона не подходит для определения ятрогенного гиперадренокортицизма. Также она довольно длительна по продолжительности – 8 часов. Тем не менее, она более надежна для подтверждения гиперадренокортицизма, так как позволяет диагностировать у собак все случаи гиперадренокортицизма надпочечникового происхождения и в 90-95 % случаях гипофизарный гиперадренокортицизм. Концентрация кортизола более 40 нмоль/л через 8 часов предполагает подтверждение диагноза гиперадренокортицизм.
Стимулирующая проба с АКТГ является лучшим выбором для дифференциации спонтанного и ятрогенного гиперадренокортицизма. Проба с АКТГ является незаменимой для мониторинга лечения синдрома Кушинга.
Хирургическое лечение применимо в случае с гиперадренокортицизмом надпочечникового происхождения имеет лучший прогноз, если опухоль может быть полностью удалена хирургическим путем. Односторонняя адреналэктомия требует большого опыта и экспертной оценки, из-за сложной анатомии. Техника хорошо описана с использованием паракостального, бокового доступа. Во время проведения операции и после нее требуется дополнительное введение глюкокортикоидов и минералокортикоидов, так как кора противоположного надпочечника будет атрофирована и не способна адекватно отвечать на стресс.
Хирургическое лечение применимо и в случае с гипофизарным происхождением ГАК. Но хирургическое вмешательство, в данном случае, технически сложная и ассоциирована с высокой заболеваемостью и смертностью. Частыми осложнениями являются кровотечение и неполная визуализация и удаление большего поражения. Может развиться транзиторный несахарный диабет.
Медикаментозное лечение применяется довольно широко. Даже несмотря на официальную недоступность на территории России таких препаратов как Трилостан или Митотан, их применение является по сути единственным лечением ГАК.
Митотан эффективный и относительно безопасный препарат для применения у собак с гиперадренокортицизмом надпочечникового происхождения. Однако собаки с опухолью надпочечников склонны быть более устойчивыми к митотану, чем собаки с гипофизарным гиперадренокортицизмом. Митотан назначают внутрь в дозе 50 мг/кг/день. Его следует давать вместе с кормом, так как это жирорастворимый препарат. Лечение митотаном относительно безопасно, а побочные эффекты, которые возникают наиболее часто, например, анорексия, рвота или диарея, редко серьезны, при условии, что их рано заметили, так что лечение митотаном может быть приостановлено.
Подводя итог данному обзору, можно отметить широкие возможности диагностики синдрома Кушинга, а также распространенные методы лечения данного заболевания. Продолжительность жизни собаки с ГАК, в среднем, 30 месяцев. Так, например, пациент бостон-терьер «Тема», являющийся пациентом автора, на текущий момент имеет продолжительность жизни после постановки диагноза 18 месяцев.
Также необходимо отметить факт, что в 80-85% случаев диагностируется гипофизарный гиперадренокортицизм.
Витамин B. Гипервитаминоз
Введение
Витамины В – обширная группа веществ, поступающих в организм извне и жизненно необходимых в качестве природных биохимических катализаторов, коферментов и, – подобно гормонам, – регуляторов.
Все витамины В растворяются в воде, что определяет особенности их метаболизма и усвоения. Это вторая по счету (потому и названная второй буквой латинского алфавита) группа витаминов, научно классифицированная и описанная в ее прикладном медицинском значении. Отдельные вещества этого кластера были известны уже во второй половине ХIХ века; например, никотиновая кислота, впоследствии названная витамином В3, впервые была получена в 1867 году. Однако первооткрывателем ее биологической роли как одного из витаминов считается польско-американский биохимик К.Функ (1911), а окончательное подтверждение и уточнение эта роль получила лишь в 1937 году благодаря работам К.Элвейджема.
Более подробно о витаминах группы В, их значении и последствиях нехватки см. материал «Витамин В. Гиповитаминоз».
Передозировка витаминов наблюдается реже, чем их дефицит, однако в ряде случаев гипервитаминоз приводит к еще более тяжелым последствиям. В особенности это касается жирорастворимых витаминов, которые аккумулируются в тканях и практически не выводятся с мочой. Однако и в отношении водорастворимых групп, в т.ч. группы В, известны и изучены весьма серьезные клинические эффекты передозировки.
Причины
Передозировать витамины В естественным, т.е. алиментарным (пищевым) способом практически невозможно: эти соединения быстро реагируют во множестве биохимических процессов, продукты реакций быстро усваиваются, избыток и отработанный остаток столь же быстро выводятся. Кроме того, при определенных условиях (стрессогенные ситуации, физические нагрузки, употребление алкоголя и т.д.) метаболизм витаминов группы В ускоряется в 8-10 раз. К слову, именно поэтому нет смысла приводить здесь таблицы с универсальными суточными дозами потребления: они резко отличаются у «среднестатистического» здорового взрослого и «среднего» же ребенка (причем имеют значение конкретные возрастные категории, к которым относятся тот и другой); у профессионального спортсмена и фанатичного телеболельщика; у беременной женщины и водителя такси, и т.д. Следует учитывать и то, что оптимальная суточная и предельно допустимая доза (при превышении которой начинается собственно интоксикация) у витаминов В различаются на один-два порядка, то есть даже существенное, казалось бы, злоупотребление витаминизированной пищей является в данном случае сравнительно безопасным (в отличие, опять же, от продуктов, богатых жирорастворимыми витаминами).
Основной причиной гипервитаминоза выступает избыточное потребление витаминных добавок, лечебных и профилактических средств с высокой концентрацией витаминов В. Данное явление известно со времен «витаминомании» 1960-70-х годов и по сей день наблюдается в странах с развитым фармацевтическим рынком, активной (а то и агрессивной) рекламой такого рода препаратов и безрецептурной их продажей. В отдельных случаях гипервитаминоз В становится следствием неверно рассчитанной врачом терапевтической дозы. Большинство же случаев обусловлено в корне неверным пониманием и отношением к витаминам, которые порой принимаются (или, хуже того, ежедневно даются детям) из соображений «Чем больше, тем лучше», «Зимой лишняя витаминка не повредит» и т.п. Между тем, передозировка некоторых витаминов отнюдь не безобидна, и от времени года это не зависит.
Изредка причиной гипервитаминоза становятся метаболические расстройства, при которых нарушается усвоение витаминов В или каких-либо их кореагентов, – поскольку большинство витаминов находятся в сложном биохимическом взаимодействии с другими витаминами, биоактивными веществами (ферментами, гормонами и т.д.) и лекарственными средствами. Эти взаимодействия необходимо учитывать при разработке и назначении поливитаминной терапии (например, витамины В9 и В12 назначаются, как правило, в комплексе, при этом следует обеспечить нормальное поступление витамина С); в противном случае в организме может развиться избыток одних витаминов и дефицит других.
Симптоматика
Учитывая приведенные выше особенности метаболизма витаминов В, можно было бы предполагать статистическое преобладание одномоментных, острых передозировок, обусловленных более или менее случайным приемом концентрированных препаратов в больших объемах. Однако если к биохимическим нюансам добавить психологические (самоназначенные лечение и профилактика) и ятрогенные (неадекватные дозировки предписанной врачом витаминотерапии), становится понятной также значительная доля хронических гипервитаминозов В.
Абсолютное большинство таких случаев составляют передозировки В1, В3, В5, В6, В9 и В12.
Наиболее типичными и общими симптомами являются повышенная возбудимость, эмоциональная неустойчивость, тахикардия, головные боли, тошнота, покраснение кожных покровов, диссомния (те или иные нарушения сна).
Витамин В1 (тиамин) в избыточной дозе может стать причиной анафилактического шока, кожных реакций по типу крапивницы и повышенной фоточувствительности, дисфункция почек и печени.
Витамин В3 (ниацин, витамин РР, никотиновая кислота) при передозировках вызывает, кроме указанного выше симптомокомплекса, выраженную диспепсию, головокружение, зуд и парестезии (ложные тактильные ощущения), боли в мышцах, нарушения сердечнососудистой деятельности (аритмия, «провал» АД в позе стоя).
Острый гипервитаминоз В5 (пантотеновая кислота) может стать, кроме прочего, причиной дегидратации.
Передозировка В6 (адермин, пиридоксин) – атактические явления в виде нарушенной координации движений, спутанность сознания, судороги, повышенная кислотность желудочного секрета.
Гипервитаминоз В9 (фолиевая кислота) – судороги в нижних конечностях, аллергические реакции. Кроме того, в 2016 году были опубликованы результаты исследования, проведенного сотрудниками Института Джонса Хопкинса (США) по медико-статистическим данным за период 1998-2013 гг. Было показано, что необоснованное и заведомо избыточное потребление фолиевой кислоты и кобальтсодержащих витаминов В12 беременными женщинами (а значение этих витаминов в период гестации общеизвестно) в 2-3 раза увеличивает риск аутизма у детей, особенно если «гиперпрофилактика» приходилась на третий триместр. Кроме того, В12 повышает свертываемость крови и, соответственно, риск тромбообразования. Вообще, результаты исследования заставляют серьезно задуматься и в очередной раз поднимают вопрос о целесообразности, необходимости самого тщательного контроля, учета всех показаний и противопоказаний к витаминотерапии и витаминопрофилактике при беременности: во многих случаях оптимальный уровень концентрации «обычных витаминов» в крови был превышен в 15-17 и более раз.
К наиболее тяжелым осложнениям гипервитаминоза В относятся почечная и печеночная недостаточность, стеатогепатоз, отеки легких, анафилактический шок, обострения гастроэнтерологических и кардиологических заболеваний.
Интересно отметить, что клиника гипервитаминоза В во многом напоминает или даже повторяет симптоматику гиповитаминоза.
Диагностика
Любое подозрение на гипо- или гипервитаминоз, включая гипервитаминоз В, прежде всего требует подробного анализа рациона, образа жизни обследуемого (алкоголизм, перегрузки, хронический стресс и др.), основных анамнестических сведений (возраст, пол, перенесенные или хронические заболевания), и особенно – принимаемых на момент обращения лекарственных средств и биологически активных добавок. По мере диагностической необходимости назначаются лабораторные и инструментальные исследования.
Лечение
При выраженных нарушениях со стороны центральной нервной, иммунной или сердечнососудистой систем больной госпитализируется. Первоочередными мерами становятся дезинтоксикация и выявление причин гипервитаминоза. Затем принимаются меры по нормализации потребления витаминов и устранению факторов риска, назначается симптоматическое лечение.
Болезнь Иценко-Кушинга
Болезнь Иценко-Кушинга (БИК) — это тяжелое многосимптомное заболевание гипоталамо-гипофизарного генеза, протекающее с проявлениями клинической картины гиперкортицизма, обусловленное наличием опухоли гипофиза или его гиперплазии и характеризующееся повыше
Болезнь Иценко-Кушинга (БИК) — это тяжелое многосимптомное заболевание гипоталамо-гипофизарного генеза, протекающее с проявлениями клинической картины гиперкортицизма, обусловленное наличием опухоли гипофиза или его гиперплазии и характеризующееся повышенной секрецией адренокортикотропного гормона (АКТГ), увеличением продукции гормонов корой надпочечников.
Считается, что при БИК у 85% больных имеется аденома передней доли гипофиза (кортикотропинома), что, по современным представлениям, является первопричиной заболевания. Кортикотропиномы характеризуются небольшими размерами. Это так называемые микроаденомы, располагающиеся внутри турецкого седла. Макроаденомы встречаются при БИК значительно реже. У 15% пациентов с БИК находят диффузную или узелковую гиперплазию АКТГ-продуцирующих клеток (кортикотрофов). Редко у больных БИК обнаруживается первичное «пустое» турецкое седло, либо никаких изменений в этой области на КТ и МРТ не выявляется.
Этиология и патогенез
Причина болезни Иценко-Кушинга точно не установлена. БИК чаще встречается у женщин, редко диагностируется в детском и пожилом возрасте. У женщин заболевание развивается в возрасте от 20 до 40 лет, есть зависимость от беременности и родов, а также от травм головного мозга и нейроинфекций. У подростков БИК часто начинается в период полового созревания.
Установлено, что большинство таких опухолей по своей природе являются моноклональными, что свидетельствует о наличии генных мутаций в исходных клетках.
В онкогенезе АКТГ-продуцирующих опухолей гипофиза важная роль принадлежит аномальной чувствительности гипофиза к гипоталамическим факторам. Усиление стимулирующего действия нейрогормонов или ослабление ингибирующих сигналов имеет значение в процессах образования и роста опухоли гипофиза. Нарушение действия ингибирующих нейрогормонов, таких, как соматостатин и допамин, может сопровождаться усилением деятельности стимулирующих нейрогормонов. Кроме того, имеются данные, свидетельствующие о том, что неконтролируемая клеточная пролиферация опухолей гипофиза может стать результатом нарушения действия ростовых факторов.
Потенциальным механизмом развития кортикотропином может стать спонтанная мутация генов рецепторов КРГ или вазопрессина.
Автономная секреция АКТГ опухолью приводит к гиперфункции коры надпочечников. Поэтому основная роль в патогенезе БИК отводится повышению функции коры надпочечников. При АКТГ-зависимой форме болезни Иценко-Кушинга имеет место повышение функциональной активности всех трех зон коры надпочечников: изменения в клетках пучковой зоны ведут к гиперсекреции кортизола, клубочковой — к повышению альдостерона и сетчатой — к усилению синтеза дегидроэпиандростерона (ДГЭС).
Для болезни Иценко-Кушинга характерно не только повышение функционального состояния коры надпочечников, но и увеличение их размеров. В 20% случаев на фоне гиперплазии надпочечников обнаруживаются вторичные аденомы небольших размеров (1–3 см).
При кортикотропиномах кроме гиперсекреции АКТГ наблюдается нарушение функции гипофизарных гормонов. Так, базальная секреция пролактина у больных с БИК нормальная или незначительно повышена. Соматотропная функция гипофиза у больных с кортикотропиномами снижена. Стимулирующие тесты с инсулиновой гипогликемией, аргинином и L-Допа показали снижение резервов СТГ при болезни Иценко-Кушинга. Уровень гонадотропных гормонов (ЛГ, ФСГ) у больных снижен. Это обусловлено прямым супрессивным действием избытка эндогенных кортикостероидов на секрецию рилизинг-гормонов гипоталамусом.
Клиническая картина
Клиническая картина болезни Иценко-Кушинга обусловлена избыточной секрецией кортикостероидов и, в первую очередь, глюкокортикоидов. Увеличение массы тела характеризуется своеобразным («кушингоидный» тип ожирения) неравномерным перераспределением подкожно-жировой клетчатки в области плечевого пояса, надключичных пространств, в области шейных позвонков («климактерический горбик»), живота, при сравнительно тонких конечностях. Лицо становится круглым («лунообразное»), щеки — багрово-красного цвета («матронизм»). Кроме того, при БИК наблюдаются трофические изменения кожи. При осмотре кожные покровы истонченные, сухие с наклонностью к гиперкератозу и имеют багрово-цианотичную окраску. На бедрах, груди, плечах, животе появляются своеобразные полосы растяжения (стрии) красно-фиолетового цвета. Характер стрий — «минус» ткань. Эти стрии отличаются от бледных или розовых полос растяжения, которые встречаются при ожирении, в период беременности или родов. Появление стрий при БИК связано с нарушением белкового обмена (катаболизм белков), в результате чего кожа истончается. Наличие гематом при незначительных травмах является следствием повышенной ломкости капилляров и истончения кожи. Наряду с этим отмечается гиперпигментация кожных покровов в местах трения (шея, локтевые суставы, подмышечные впадины). У женщин часто наблюдается повышенное оволосение (гирсутизм) на лице (усы, борода, бакенбарды) и груди. Половые расстройства в виде вторичного гипогонадизма являются одним из ранних симптомов при БИК.
В симптомокомплексе БИК наиболее существенным в клинической картине заболевания является поражение сердечно-сосудистой системы. Сочетание артериальной гипертонии с нарушениями метаболизма в сердечной мышце приводит к хронической недостаточности кровообращения и другим изменениям со стороны сердечно-сосудистой системы. Миопатия часто является характерным симптомом гиперкортицизма, который выражается дистрофическими изменениями мышц и гипокалиемией. Атрофические процессы, затрагивающие поперечно-полосатую и мышечную систему, особенно заметны в верхних и нижних конечностях («истончение» рук и ног). Атрофия мышц передней брюшной стенки ведет к увеличению живота.
Содержание калия в эритроцитах и мышечной ткани (в том числе и в миокарде) значительно снижено. Нарушения электролитного обмена (гипокалиемия и гипернатриемия) лежат в основе электролитно-стероидной кардиопатии и миопатии. При БИК нарушения углеводного обмена различной степени выраженности наблюдаются у большого числа больных. При этом у 70–80% пациентов выявляется нарушенная толерантность к глюкозе, а у остальных — сахарный диабет 2 типа. Клинические проявления диабета характеризуются гиперинсулинемией, инсулинорезистентностью и отсутствием склонности к кетоацидозу. Диабет имеет, как правило, благоприятное течение, и для его компенсации достаточно назначения диеты и пероральных сахароснижающих препаратов.
Вторичный иммунодефицит проявляется гнойничковыми (акне) или грибковыми поражениями кожи и ногтевых пластин, трофическими язвами голеней, длительным периодом заживления послеоперационных ран, хроническим и трудно поддающимся лечению пиелонефритом. Энцефалопатия в виде изменения вегетативной нервной системы при БИК ярко выражена и многообразна. Синдром вегетативной дистонии характеризуется эмоционально-личностными сдвигами: от нарушения настроения, сна и до выраженных психозов.
Системный остеопороз представляет собой распространенное и нередко тяжело протекающее проявление гиперкортицизма при БИК в любом возрасте. Остеопороз является причиной болей в позвоночнике, часто приводит к снижению высоты тел позвонков и спонтанным переломам ребер и позвонков.
В зависимости от выраженности гиперкортицизма и формирования клинических симптомов различают несколько степеней тяжести БИК. Легкая форма характеризуется умеренной выраженностью симптомов заболевания; средняя — выраженностью всех симптомов при отсутствии осложнений. Тяжелая форма отличается выраженностью симптомов и наличием осложнений (сердечно-легочная недостаточность, стероидный диабет, прогрессирующая миопатия, патологические переломы, тяжелые психические расстройства). В зависимости от скорости нарастания клинической симптоматики различают быстропрогрессирующее (три–шесть месяцев) и торпидное течение заболевания, которое проявляется сравнительно медленным (от одного года и более) развитием гиперкортицизма.
При подозрении на БИК необходимо проверить, имеется ли у больного гиперкортицизм, затем провести дифференциальную диагностику форм гиперкортицизма (БИК, АКТГ-эктопированный синдром, синдром Иценко-Кушинга), сходных синдромов (ожирение, метаболический синдром, пубертатно-юношеский диспитуитаризм, алкогольное поражение печени) и установить локализацию основного патологического процесса.
Диагноз и дифференциальный диагноз
При подозрении на болезнь Иценко-Кушинга после сбора анамнеза и клинического осмотра у всех больных с помощью методов лабораторной диагностики необходимо подтвердить наличие гиперкортицизма. На первом этапе выявляется повышенная продукция кортизола. С этой целью определяют суточный ритм секреции кортизола в плазме крови утром (8.00-9.00) и вечером (23.00-24.00). Для больных БИК характерно повышение утреннего уровня кортизола в плазме крови, а также нарушение ритма секреции кортизола, т. е. в ночное или вечернее время уровень кортизола остается повышенным. Определение суточной экскреции свободного кортизола в моче является также необходимым методом лабораторной диагностики для подтверждения гиперкортицизма. Уровень свободного кортизола в моче определяется РИА-методом. Для здоровых лиц содержание кортизола колеблется от 120 до 400 нмоль/с. У больных с БИК экскреция кортизола в суточной моче повышена.
В сомнительных случаях для дифференциальной диагностики между патологическим эндогенным и функциональным гиперкортицизмом проводится малая проба с дексаметазоном. Она основана на подавлении продукции эндогенного АКТГ высокими концентрациями кортикостероидов по принципу обратной связи. Если секреция кортизола не снижается на 50% и более от исходного уровня, это свидетельствует о наличии гиперкортицизма.
Таким образом проводится дифференциальная диагностика патологического и функционального гиперкортицизма.
При выявлении повышенной продукции кортизола необходимо провести следующий этап обследования — дифференциальную диагностику между формами эндогенного патологического гиперкортицизма (БИК, СИК, АКТГ-эктопированный синдром), болезнью Иценко-Кушинга, АКТГ-эктопированным синдромом и синдромом Иценко-Кушинга. Этот этап обследования включает в себя определение ритма секреции АКТГ в плазме крови и проведение большой пробы с дексаметазоном.
Для БИК характерны нормальное или повышенное (до 100 –200 пг/мл) утреннее содержание АКТГ и отсутствие его снижения в ночное время. При АКТГ-эктопированном синдроме секреция АКТГ повышена и может колебаться от 100 до 200 пг/мл и выше, и при этом также отсутствует ритм его секреции. При АКТГ-независимых формах гиперкортицизма (синдром Иценко-Кушинга, макро- или микроузелковая дисплазия надпочечников) утреннее содержание АКТГ, как правило, снижено при отсутствии ритма его секреции.
Большая проба с дексаметазоном в настоящее время широко применяется для диагностики патологического гиперкортицизма.
При БИК, как правило, происходит снижение уровня кортизола на 50% и более от исходного уровня, тогда как при АКТГ-эктопированном синдроме это наблюдается лишь в редких случаях. При АКТГ-независимых формах синдрома Иценко-Кушинга указанного снижения уровня кортизола также не отмечается, так как продукция гормонов опухолью не зависит от гипоталамо-гипофизарных взаимоотношений.
В зарубежной литературе для диагностики БИК широко используется проба с кортиколиберином (КРГ). Введение КРГ приводит к стимуляции секреции АКТГ у больных БИК. При БИК содержание АКТГ в плазме крови увеличивается более чем на 50%, а уровень кортизола на 20% от исходного. При АКТГ-эктопированном синдроме концентрация АКТГ практически не меняется.
Методы топической диагностики при БИК используются для выявления патологического процесса в гипоталамо-гипофизарной области и надпочечниках (диагностика микро- или макроаденомы гипофиза и гиперплазии надпочечников). К таким методам следует отнести рентгенографию костей черепа, КТ или МРТ головного мозга, УЗИ надпочечников и КТ или МРТ надпочечников.
Визуализация кортикотропином представляет собой наиболее диагностически сложную задачу, так как размер их бывает очень небольшой (2–10 мм). При этом в поликлинических условиях в первую очередь проводится рентгенография костей черепа (боковая рентгеновская краниограмма) с целью выявления рентгенологических признаков аденомы гипофиза. Существуют следующие явные или косвенные признаки аденомы гипофиза: изменение формы и увеличение размеров турецкого седла, локальный или тотальный остеопороз спинки седла, «двухконтурность» дна, выпрямление передних и задних клиновидных отростков.
В настоящее время магнитно-резонансную томографию и/или компьютерно-томографическое исследование принято считать основными методами диагностики аденомы гипофиза. Методом выбора при визуализации кортикотропином является МРТ или МРТ с контрастированием. Преимуществами этого метода, по сравнению с КТ, можно считать лучшую выявляемость микроаденомы гипофиза и синдрома «пустого» турецкого седла, который может встречаться при болезни Иценко-Кушинга.
Лечение БИК
Лечение БИК должно быть направлено на исчезновение основных клинических симптомов гиперкортицизма, стойкую нормализацию уровня АКТГ и кортизола в плазме крови с восстановлением их суточного ритма и нормализацию кортизола в суточной моче.
Все методы лечения болезни Иценко-Кушинга, которые используются в настоящее время, можно разделить на четыре группы: нейрохирургическое (транссфеноидальная аденомэктомия), лучевое (протонотерапия, γ-терапия), комбинированное (лучевая терапия в сочетании с односторонней или двусторонней адреналэктомией) и медикаментозное лечение. Из них основные виды — нейрохирургическое, лучевое и комбинированное; медикаментозная терапия применяется как дополнение к ним.
В настоящее время во всем мире предпочтение отдается транссфеноидальной аденомэктомии. Этот метод позволяет добиться быстрой ремиссии заболевания с восстановлением гипоталамо-гипофизарных взаимоотношений у 84–95% больных уже через шесть месяцев. Показанием к аденомэктомии служит четко локализованная (на основании данных КТ или МРТ) опухоль гипофиза. Аденомэктомия может быть проведена повторно, если имеется подтвержденный на КТ или МРТ продолженный рост аденомы гипофиза, в любые сроки после операции. Этот метод характеризуется минимальным количеством осложнений (около 2–3%) и очень низкой послеоперационной летальностью (0–1%).
Адреналэктомия — тотальная одно- или двусторонняя — применяется только в комбинации с лучевой терапией. При крайне тяжелой и прогрессирующей форме заболевания осуществляется двусторонняя адреналэктомия в сочетании с лучевой терапией для профилактики развития синдрома Нельсона (прогрессирование роста аденомы гипофиза при отсутствии надпочечников). После тотальной двусторонней адреналэктомии пациент пожизненно получает заместительную гормональную терапию.
Из методов лучевой терапии в настоящее время используются протонное облучение и дистанционная γ-терапия, при этом предпочтение отдается протонотерапии. Протонное облучение наиболее эффективно в связи с тем, что энергия выделяется в области аденомы гипофиза и при этом окружающие ткани затрагиваются минимально. Абсолютным противопоказанием к проведению протонотерапии является опухоль гипофиза более 15 мм в диаметре и супраселлярное ее распространение с дефектом полей зрения.
γ-терапия как самостоятельный метод лечения применяется в последнее время редко и только при невозможности проведения аденомэктомии или протонотерапии. Эффективность действия этого метода следует оценивать не раньше, чем через 12–15 и более месяцев после проведения курса облучения.
Медикаментозная терапия при БИК должна использоваться в следующих случаях: подготовка пациента к проведению лечения основным методом, облегчение течения послеоперационного периода и сокращение срока наступления ремиссии заболевания. Фармакологические препараты, применяемые с этой целью, делятся на несколько групп: производные аминоглютетимида (мамомит 250 мг, ориметен 250 мг, средняя суточная доза — 750 мг/сут, максимальная суточная доза — 1000–1500 мг/сут), производные кетоконазола (низорал 200 мг/сут, суточная доза — 400–600 мг/сут, максимальная суточная доза — 1000 мг/сут) и производные пара-хлорфенила (хлодитан, лизодрен, митотан, начальная доза — 0,5 г/сут, лечебная доза — 3–5 г/сут). Принципы медикаментозной терапии следующие: после определения степени переносимости лекарственного средства лечение надо начинать с максимальных доз. На фоне приема препарата необходимо осуществлять контроль за содержанием кортизола в плазме крови и суточной моче не реже чем один раз в 10–14 дней. В зависимости от уровня снижения кортизола в каждом конкретном случае подбирается поддерживающая доза препарата. Передозировка препаратами, блокирующими биосинтез стероидов в надпочечниках, может приводить к развитию надпочечниковой недостаточности.
Из препаратов, ингибирующих действие АКТГ, преимущественно используются бромокриптин-парлодел (в дозе 2,5 –5 мг) или отечественный препарат абергин, (в дозе 4–8 мг).
Коррекцию электролитного обмена необходимо проводить как до начала лечения основного заболевания, так и в ранний послеоперационный период. Наиболее целесообразно применение препаратов калия (раствор хлористого калия или таблеток ацетата калия 5,0 г и более в день) в сочетании с спиронолактонами, в частности верошпироном. Рекомендуемая доза верошпирона до 200 мг/сут перорально.
Подходы к лечению артериальной гипертонии при гиперкортицизме такие же, как и при артериальной гипертонии без повышения функции надпочечников. Надо отметить, что у большинства пациентов с БИК не удается достичь оптимального АД без снижения уровня кортизола.
Патогенетический подход к терапии сахарного диабета при гиперкортицизме предполагает эффективное воздействие на основные звенья: инсулинорезистентность периферических тканей и неспособность инсулярного аппарата преодолеть эту резистентность. Обычно предпочтение отдается сульфаниламидным препаратам второго поколения, так как они обладают большей активностью и меньшей гепато- и нефротоксичностью.
Начинать лечение сульфонилмочевинными препаратами следует с минимальной дозы. При необходимости дозу увеличивают, ориентируясь на результаты измерений уровня глюкозы в крови. Если лечение не дает желаемых результатов, следует сменить препарат. Во время лечения любыми сахароснижающими средствами больной должен соблюдать диету. Если лечение максимальными дозами производными сульфонилмочевины (ПСМ) оказывается безрезультатным, можно использовать их комбинацию с бигуанидами. Теоретическое обоснование необходимости комбинированной терапии основывается на том, что препараты этих групп имеют различные точки приложения своего основного действия. Метформин — 400 мг (cиофор — 500 и 850 мг, глюкофаж — 500, 850 и 1000 мг) — единственный на сегодняшний день препарат бигуанидов, который снижает инсулинорезистентность. Инсулинотерапия показана при БИК в тех случаях, когда не удается нормализовать уровень глюкозы в крови с помощью пероральных сахароснижающих препаратов или планируется хирургическое вмешательство. Применяется инсулин короткого действия, препараты средней длительности и длительного действия и их комбинация. Операция должна планироваться на первую половину дня: перед операцией вводят инсулин короткого действия или средней продолжительности действия п/к. Во время операции проводят инфузию 5% глюкозы в/в с добавлением инсулина короткого действия из расчета 5 — 10 ЕД/л, скорость инфузии — 150 мл/ч. Инфузию 5% глюкозы с инсулином короткого действия продолжают и после операции, пока больной не начнет самостоятельно принимать пищу. Затем пациент переводится на пероральные сахароснижающие препараты и осуществляется контроль сахара крови.
Лечение стероидного остеопороза (СОП) даже после ликвидации гиперкортицизма длительное. Препараты для лечения СОП условно можно разделить на три группы: средства, влияющие на процессы костной резорбции, препараты, стимулирующие костное формирование, и препараты многопланового действия. К препаратам, снижающим резорбцию костной ткани, относится кальцитонин (миокальцик). Этот препарат используется в двух лекарственных формах: в ампулах и в виде назального спрея. Курсы длительностью два месяца следует проводить три раза в год. Бисфосфонаты (фосамакс, ксидифон) относятся к препаратам, которые снижают резорбцию костной ткани. При терапии бисфосфонатами рекомендуется дополнительный прием солей кальция (500–1000 мг в сутки). Одним из наиболее эффективных препаратов, стимулирующих костеобразование и увеличивающих массу кости, являются соли фтора. Лечение продолжают от шести месяцев до одного года.
Считается, что анаболические стероиды уменьшают костную резорбцию и индуцируют положительный кальциевый баланс благодаря увеличению абсорбции кальция из кишечника и реабсорбции кальция почками. Кроме того, по некоторым данным, они стимулируют активность остеобластов и увеличение мышечной массы. Они назначаются в основном парентерально, прерывистыми курсами по 25–50 мг один-два раза в месяц в течение двух месяцев три раза в год.
Препараты активного метаболита витамина Д (оксидевит, альфа Д3-Тева) широко применяются при БИК. При СОП они используются в дозе 0,5–1,0 мкг/дн как в качестве монотерапии, так и в комбинации с другими препаратами (Д3+кальцитонин, Д3+соли фтора, Д3+бисфосфанаты). При комплексном лечении БИК и СОП также возможно применение препарата остеопан, содержащего кальций, витамин Д3, магний и цинк, назначая по две таблетки три раза в день.
Симптоматическое лечение СОП включает в себя обезболивающую терапию: анальгетики, назначение нестероидных противовоспалительных средств, а также центральных миорелаксантов, так как на генез боли при СОП оказывает влияние и спазм параспинальных мышц. Соли кальция самостоятельного значения при лечении стероидного ОП не имеют, но являются обязательным компонентом комплексной терапии. В клинической практике предпочтение в настоящее время отдается быстрорастворимым солям кальция. Кальций форте содержит в одной растворимой таблетке 500 мг кальция-элемента. Препараты кальция следует назначать в один прием, на ночь. При лечении СОП кальций надо применять ежедневно в суточной дозе 500–1000 мг в комбинации с препаратами патогенетической терапии ОП. Абсолютным показанием для назначения корсета при СОП являются боли в спине и наличие компрессионных переломов тел позвонков.
Прогноз БИК зависит от длительности, тяжести заболевания и возраста больного. При небольшой длительности заболевания, легкой форме и возрасте до 30 лет прогноз благоприятный. После адекватного лечения наблюдается выздоровление. При среднетяжелой форме заболевания и при длительном его течении у больных после нормализации функции гипофиза и надпочечников часто остаются необратимые изменения со стороны сердечно-сосудистой системы и костной системы, которые требуют дополнительного лечения. Вследствие двусторонней адреналэктомии у пациентов развивается хроническая надпочечниковая недостаточность. При стабильной надпочечниковой недостаточности и отсутствии тенденции к росту аденомы гипофиза прогноз благоприятный, хотя трудоспособность больных ограничена.
С. Д. Арапова, кандидат медицинских наук
Е. И. Марова, доктор медицинских наук, профессор
Эндокринологический научный центр РАМН, Москва