С чем связана радиочувствительность тканей
С чем связана радиочувствительность тканей
Радиочувствительность — это ответ опухоли на облучение, который измеряется степенью регрессии, скоростью ее наступления и длительностью. Радиочувствительность зависит от ряда факторов: способности клеток устранять повреждение, гипоксии, периода клеточного цикла и доли растущих клеток. Кроме того, возможность ликвидации опухоли определяется ее начальным объемом.
Важно понимать, что термины «радиочувствительность» и «способность излечить лучевой терапией» имеют разные значения. Относительно радиорезистентпые новообразования, доступные для локального подведения высоких доз облучения, могут быть излечены, но радиочувствительные метастатические опухоли излечить с помощью одной лучевой терапией (ЛТ) нельзя: может быть достигнут только местный эффект.
Прекрасный пример относительно радиорезистентного новообразования — плоскоклеточный рак шейки матки (РШМ). Эта опухоль остается одной из самых излечиваемых, что объясняется возможностью подведения к ней высоких доз излучения и ее происхождением из тканей, которые также относительно радиорезистентны. Ключ к успешному лечению — хорошие условия для расположения радия или цезия в непосредственной близости к опухоли без превышения дозы на окружающие нормальные ткани выше переносимой.
Множество попыток было предпринято, чтобы найти способ определения радиочувствительности опухоли. Однако в настоящее время не существует надежного метода прогнозирования результата лечения данной конкретной опухоли. Не исключено, что опухоли состоят из нескольких популяций клеток с различной чувствительностью к XT и ЛТ. Чувствительные клетки погибают, а резистентные — продолжают расти. Это объясняет, почему вначале ответившие на лечение опухоли в конечном счете не излечиваются.
Для прогнозирования и изучения радиочувствительности опухолевых клеток разработаны модели in vitro. Клеточная радиочувствительность определяется в основном потерей репродуктивной способности, которую показывает кривая выживаемости, характеризующаяся начальным наклоном а и конечным b, причем а отражает невосстановимые повреждения клетки, а b — восстановимые. Отношение а/b — доза, при которой вклад от а эквивалентен вкладу от и, и есть показатель радиочувствительности.
Большие значения отношения характерны для быстроделящихся клеток, они помогают предсказать ответ опухолей и оценить раннюю эффективность облучения. Низкие значения характеризуют поздно реагирующие ткани.
Размер плеча кривой выживаемости дает важную информацию, т. к. отражает величину репарации сублетальных повреждений. Широкие плечи имеют низкие отношения а/b и хорошую репарацию сублетальных повреждений, которая занимает 2—6 ч. Способность клеток восстанавливать сублетальные повреждения служит основанием для фракционирования дозы ЛТ, при котором используются различия между способностью нормальных и опухолевых тканей к репарации.
Различная способность к репарации также служит основой для ускоренного фракционирования и гиперфракционирования, при которых доза подводится 2 раза в день. Такой подход дает хорошие результаты при быстро растущих опухолях. Лечение 2 раза в сутки оставляет достаточный срок нормальным тканям для репарации, тогда как опухолевые, менее организованные ткани погибают в силу нехватки времени для восстановления.
Некоторые клетки почти не имеют плеча на графике, что говорит об их ограниченной способности к репарации сублетальных повреждений; эти клетки погибают от относительно небольших доз радиации. Например, дисгерминомы излечиваются сравнительно невысокими дозами облучения (20—30 Гр) по сравнению с опухолями шейки матки, к которым необходимо подвести более 70 Гр для получения полного эффекта.
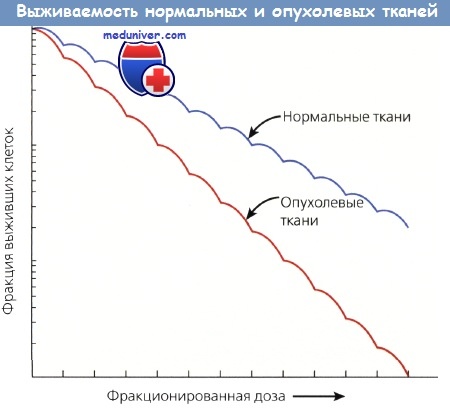
Нормальные ткани восстанавливаются быстрее и эффективнее
Доступ кислорода также имеет большое значение для радиочувствительности клетки. Излучение в клетке взаимодействует с органическими молекулами (ДНК). ДНК может восстановиться, если молекула кислорода не присоединится к ней, «фиксируя» повреждение. Надо отметить, что кислород усиливает эффект излучения с низкой ЛПЭ (фотоны), но не оказывает аналогичного действия при облучении пучком с высокой ЛПЭ.
Способность кислорода усиливать излучение, или коэффициент кислородного усиления, вычисляется как отношение дозы излучения, производящей определенный эффект без кислорода, к дозе, дающей тот же эффект, но в присутствии кислорода. Для наблюдения полного кислородного эффекта необходимо наличие по крайней мере 2 % (17 мм рт. ст.) тканевого кислорода.
Способность опухолевых клеток к росту потенциально не ограничена, но практически зависит от поступающих с кровью питательных веществ. Известно, что любая опухоль размером более 200 мкм имеет некроз в центре вследствие ограниченной способности кислорода диффундировать на большие расстояния. Кислород легко проникает на 70 мкм от кровеносного сосуда.
Клетки, располагающиеся дальше этого расстояния, страдают от нехватки кислорода и переходят в фазу покоя. В них может развиться гипоксия и даже аноксия и некроз. Это важно с точки зрения радиобиологии, т. к. покоящиеся клетки проявляют более выраженную способность к восстановлению радиационных повреждений. Клетки в состоянии гипоксии более резистентны к облучению, чем нормально оксигенированные. Таким образом, большие опухоли труднее излечить с помощью ЛТ не только из-за большего числа составляющих их клеток, но и вследствие нахождения в них гипоксических, покоящихся и радиорезистентных клеток.
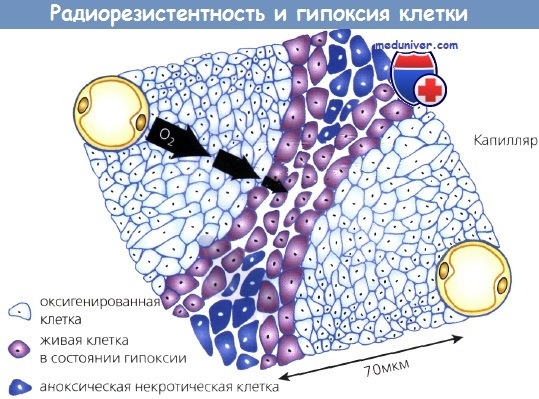
Гипоксические клетки более радиорезистентны и поэтому труднее поддаются лечению.
Кислород диффундирует примерно на 70 мкм от капилляров.
Клинический пример: замечено, что экзофитные рыхлые опухоли шейки матки, легко кровоточащие при контакте, лучше и быстрее отвечают на облучение, чем инфильтративные формы. Кровоснабжение и оксигенация этих двух видов новообразований значительно отличаются: рыхлая опухоль лучше васкуляризована и, следовательно, оксигенирована, поэтому ее радиочувствительность выше. К сожалению, к настоящему времени попытки преодолеть такое существенное различие в чувствительности к облучению с помощью гипербарической оксигенации и радиосенсибилизации не дали ожидаемых результатов.
Другим важным фактором, влияющим на радиочувствительность, служит содержание в опухоли митотических, или клоногенных, клеток. Размножающиеся клетки более чувствительны к облучению. Число митозов коррелирует с прогнозом лечения при многих опухолях. Фаза клеточного цикла тоже имеет большое значение. Клетки в поздней G2 и митотической (М) фазах наиболее чувствительны к облучению, а в поздней синтетической фазе (S) — наиболее резистентны. Это учитывается при совместном применении ЛТ и XT. Так, например, паклитаксел задерживает клетки в фазе митоза и, следовательно, выступает в роли чрезвычайно сильного радиосенсибилизатора.
От первоначального объема опухоли в значительной степени зависит возможность излечения: чем меньше объем, тем меньшая доза облучения требуется для уничтожения всехзлокачественных клеток и наоборот, при большем объеме доза, необходимая для исчезновения опухоли, возрастает. Принцип лечения сокращающимися полями заключается в последовательном уменьшении размера полей облучения с тем, чтобы подвести наибольшую дозу на центральную часть опухоли, где предположительно находятся наиболее радиорезистентные клетки в состоянии гипоксии.
В течение длительного времени клиницисты предпринимали попытки установить взаимосвязь между ответом опухоли на облучение и частотой местного рецидивировапия. В целом, чем полнее ответ опухоли к окончанию лечения и чем скорее он наступает, тем дольше период ремиссии, т. к. можно предположить, что отдаленные метастазы не появятся. Хотя эта зависимость не универсальна, при РШМ показана устойчивая корреляция между длительностью ремиссии и степенью резорбции опухоли к концу курса облучения — частичной или полной регрессией.
Grigsby установил взаимосвязь между выживаемостью и ответом опухоли к окончанию лечения, который он определял с помощью ПЭТ, основанной на измерении метаболизма глюкозы.
Другой фактор, ограничивающий излечиваемость с помощью лучевой терапии (ЛТ), — увеличение побочных эффектов со стороны нормальных тканей, связанное с повышением дозы. Появление этих осложнений зависит от суммарной дозы и дозы за фракцию, объема облученных тканей и их радиочувствительности. Цель любой терапии — достижение излечения с минимальным количеством побочных эффектов. Комбинирование ЛТ с хирургическим лечением или XT снижает толерантность нормальных тканей к облучению.
Установлены и хорошо обоснованы размеры полей, суммарные дозы и схемы фракционирования, но они не могут оставаться неизменными. Продолжают исследовать различные методы повышения процента выздоровления и снижения осложнений; для этого используют новые химиотерапевтические радиосенсибилизаторы, а также технические достижения в подведении излучения, такие как ЛТМИ и радиопротекторы, подобные этиолу.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Биологическое действие ионизирующего излучения.
Тема: Биологическое действие ионизирующего излучения.
Ионизирующее излучение было открыто в 1895 году Вильгельмом Конрадом Рентгеном в Германии, который зафиксировал неизвестные ранее лучи, которые проникали сквозь тело человека. Эти лучи, однако, не были связаны с естественной радиоактивностью. Рентген получил их в электронной лампе, разгоняя поток электронов от одного электрода к другому. Это открытие вдохновило других учёных искать таинственные лучи, и в 1896 году было сделано следующее открытие: французский физик Анри Беккерель изучал минеральный образец урана и обнаружил, что он испускал лучи того же самого типа, что и лучи Рентгена. Беккерель обнаружил явление естественной радиоактивности.
Теперь поиск химических элементов, испускающих радиацию, стал более целенаправленным. В 1898 году учёные Мария и Пьер Кюри выделили два радиоактивных элемента: полоний и радий. Радий, который является высоко радиоактивным химическим элементом, скоро оказался полезным в медицине. А в то время об опасности вредного воздействия излучения на организм не было известно.
Многие из первопроходцев в области медицины и научных исследований были облучены, и в течение первых десятилетий прошлого столетия некоторые из них погибли от лучевой болезни.
В 1928 году на Международном Конгрессе по радиологии в Стокгольме была основана международная организация – сегодня известная, как Международная Комиссия по Радиационной Защите (МКРЗ). МКРЗ собирает информацию о воздействии радиации на здоровье и выпускает рекомендации по радиационной защите.
Воздействие ионизирующего излучения на вещество.
Любое вещество, поглощая энергию солнечного излучения, нагревается. Воздействие солнечного излучения на биологическую ткань приводит к биологическим эффектам (например, загар на теле человека). Так же и ионизирующее излучение воздействует различным образом на живую и неживую материю.
Тело человека поглощает энергию и находится под биологическим воздействием ионизирующего излучения. Чтобы понять, как ионизирующее излучение воздействует на нашу биологическую ткань, исследуем процесс на уровне элементов, составляющих ткань, то есть на уровне клетки.
Клетка и молекула ДНК живого организма.
Генетический материал человека состоит из 46 хромосом, составляющих 23 пары. Внутри хромосом находится молекула ДНК, которая является сложнейшей макро-молекулой. Молекула ДНК состоит их двух цепочек в форме двойной спирали, растянув которые можно получить нить длинной около 1,5 метра
Четыре базы, названные А, С, G, Т, связывают обе спирали вместе очень оригинальным способом. А в одной спирали всегда соединяется с Т в другой спирали, С всегда соединяется с G. В случае, если одна спираль повреждена, другая служит моделью для восстановления.
Деление клетки в организме.
Клетки могут разрушиться или быть повреждены вследствие каких-либо причин. Чтобы позволить тканям тела и органам поддерживать свои функции, клетка делится с образованием двух нормальных, здоровых дочерних клеток, идентичной материнской клетке, которые заменяют повреждённую клетку.
Когда клетка делится, обе цепочки каждой молекулы ДНК разделяются, каждая затем становится частью новой спирали ДНК и в результате – мы имеем две новые клетки.
Полный процесс деления занимает от двух минут до двух часов – это очень чувствительный период в жизни клетки. Повреждение ДНК во время этого процесса может привести к различным последствиям. Однако, способность клетки к восстановлению исправит большинство дефектов прежде, чем закончится образование новой клетки.
Повреждение ДНК происходит случайно, или в результате воздействия на неё ядовитых веществ, вирусов, ультрафиолетового или ионизирующего излучения.
Воздействии ионизирующего излучения на ДНК.
Некоторые клетки являются наиболее чувствительными к ионизирующему излучению, но все они чувствительны в период деления. Это означает, что растущая ткань или ткань, которая имеет высокую скорость деления клеток, более чувствительна к ионизирующему излучению, чем другие ткани. Вот почему дети, а особенно плод беременной женщины более чувствительны к излучению, чем взрослые. По той же причине клетки раковой опухоли более чувствительны к излучению, чем здоровая ткань, так как раковая опухоль растёт очень быстро за счёт частого деления раковых клеток. Эта особенность опухоли используется для лечения рака при помощи облучения раковых клеток.
Прямые и косвенные эффекты облучения.
Ионизирующее излучение может воздействовать на ДНК непосредственно или косвенно. Наши клетки состоят на 65-75% из воды. Поэтому, наиболее вероятная молекула, которая подвергается воздействию ионизирующего излучения молекула воды. Излучение ионизирует молекулы воды, приводя к образованию различных химических активных веществ. Эти вещества, которые называются свободными радикалами, могут воздействовать на молекулу ДНК. Прямое воздействие имеет менее важное значение, поскольку оно менее вероятно. Чтобы вызвать прямой эффект, ионизирующее излучение должно разрушить молекулу ДНК.
Бета- и гамма-излучения вызывают низкую плотность ионизации, поэтому вероятность повреждения обеих цепочек спирали ДНК относительно небольшая. Обычно ущерб наносится только одной цепочке или одной базе, и это повреждение может быть восстановлено относительно эффективными функциями восстановления организма. Альфа-излучение вызывает высокую плотность ионизации. При этом возникает большая вероятность разрушения обеих цепочек ДНК. Поскольку генетическая модель клетки, таким образом, разрушается, вероятна ошибка в процессе восстановления клетки, что может даже привести к гибели клетки.
Действие радиации на организм человека.
Существуют различия между последствиями радиационного воздействия, которые возникают вскоре после облучения – острые последствия – и последствиями, которые будут наблюдаться намного позже – хронические последствия.
Острые последствия облучения.
Острые последствия обусловлены большой дозой облучения тела или органа человека за короткий срок, и в большинстве случаев приводят к гибели клеток организма. При превышении порогового значения повреждения неизбежны, и они увеличиваются с увеличением дозы. Индивидуальное пороговое значение может быть разным, и это может изменить степень повреждения каждого индивидуума. Острая лучевая болезнь и повреждение плода у беременных – примеры острых повреждений организма в результате воздействия ионизирующего излучения.
Острая лучевая болезнь.
Клетки, которые являются наиболее чувствительными к воздействию радиации – клетки с высокой частотой деления. Поэтому в первую очередь ионизирующее излучение будет воздействовать на кроветворные органы (красный костный мозг), особенно чувствительные к ионизирующему излучению. Кратковременная доза облучения на всё тело более, чем 1000 мЗв (100 бэр) приведёт к острой лучевой болезни. Множество клеток и, следовательно, большие части живой ткани будут повреждены или погибнут. Функции облучённого органа будут нарушены. Последствия интенсивного облучения организма в дозах, превышающих пороговое значение, иногда проявляются уже через час или два: человек начнёт чувствовать слабость и начнётся рвота. Эти признаки обычно уменьшаются после двух дней, и в течение двух-трёх недель – самочувствие человека улучшается. Однако, за это время число белых кровяных клеток существенно уменьшится, уменьшится и сопротивление организма заразным болезням. Это может привести к воспалительным болезням с высокой температурой, диарее и кровотечениям. Если человек поправляется от острого облучения, то останется риск хронических последствий облучения.
Незамедлительное и целенаправленное квалифицированное лечение увеличивает процент выживания.
Генетические нарушения в организме.
Различают следующие виды воздействия на клетки организма вследствие облучения в зависимости от поглощённой дозы облучения и радиоустойчивости клетки:
— Без изменений – облучение не влияет на клетку
— Клетка восстанавливает молекулу ДНК
Молекула ДНК получает ложную информацию, ведущую к мутации клетки. Мутации не обязательно отрицательные, но они могут также привести к генетическим нарушениям и раковым заболеваниям.
Хронические последствия облучения.
Рак и наследственные болезни расцениваются как хронические последствия действия радиационного облучения.
Пороговое значение дозы облучения для хронических последствий отсутствует. Чем больше доза облучения, тем выше вероятность заболевания.
Клетка, у которой генетический код был изменён, может развиться в раковую клетку. Рак – болезнь, вызванная бесконтрольным делением мутирующих клеток. Примерно 20% всех смертных случаев в мире – от раковых болезней. Признаки лейкемии, вызванной ионизирующим излучением, обнаруживаются через 3-7 лет после облучения. Другие виды раковых болезней развиваются более длительное время.
Наследственные изменения в потомстве.
ДНК в половых клетках, также могут быть повреждены ионизирующим излучением. Эти повреждения могут быть переданы следующему поколению. Но для того, чтобы это случилось, дефект клеток должен быть унаследован от обоих родителей. Необходимые условия передачи генетических изменений следующему поколению:
— Хромосома в половой клетке повреждена.
— Повреждены одинаковые хромосомы в клетках отца и матери.
— Эмбрион должен развиться. Шансы эмбриона выжить уменьшаются, если клетки повреждены.
Эти условия объясняют, почему наследственные последствия нанесения вреда организму настолько трудно оценить. Вероятность каждого условия мала. Вероятность того, что все три условия выполняются одновременно – чрезвычайно мала.
Нарушения равновесия и координации движений
Нарушение координации движения медицинским термином называется «атаксия». Это состояние является признаком процесса, который был спровоцирован проблемами функционирования и распределения нервных импульсов, направляемых из головного мозга.
Чтобы проводить результативное лечение, необходимо провести комплексную диагностику и устранить факторы, первоначально повлиявшие на процесс деятельности мозга человека. Самолечение в такой ситуации невозможно и недопустимо. Это обусловлено тем, что возможны серьезные последствия, такие как инвалидность или летальный исход.
Опорно-двигательный аппарат подвержен контролю нервной системы. Нейроны, располагающиеся в спинном и головному мозге, взаимосвязаны. Благодаря их слаженной работе, передается сигнал в главный орган человека. Оттуда исходит ответный импульс, провоцирующий действие.
При правильной работе нейронов из разных областей, сигнал получается четким и молниеносным. Если в какой-то части существуют проблемы, то импульс подается замедленно или отсутствует вовсе. Нарушения называются потерей координации движения.
Чаще всего заболевание возникает у пожилых людей, переступивших 60-летний порог, независимо от того, мужчина это или женщина. Причиной возникновения, в первую очередь, выступает старение организма и невозможность четко и в полной мере выполнять поставленные задачи. Болезнь может развиваться не только у взрослых, но и у детей.
Виды и типы
Выделяют статическое и динамическое нарушение. В первом случае проблемы с координацией возникают только при вертикальном расположении человека, когда больной стоит. Во второй ситуации дискоординация появляется при любом движении.
Диагностируются следующие типы атаксии:
Чтобы правильно диагностировать тип заболевания, сначала выявляются факторы его возникновения. На основании этих данных пациенту назначается терапия. Чтобы устранить проблему, нужно точно знать причины нарушения координации движения при ходьбе.
Причины возникновения заболевания
Проблема движения является опасной и серьезной для пациента с отклонениями. Находясь в таком состоянии, человек не имеет возможности скоординировать собственные действия.
На развитие заболевания влияет много факторов. Выделяют следующие причины:
Выявить болезнь не составляет труда, симптомы заметны невооруженным глазом. Но чтобы точно знать, какие они бывают, необходимо ознакомиться с клинической картиной.
Симптомы проявления
Люди с развивающейся болезнью плохо передвигаются, с неуверенностью, у них отсутствует равновесие, просматривается рассеянность, артикуляция нарушена. При попытке начертить в воздухе фигуру, например, круг, у больного получается зигзаг или ломаная линия.
Один из методов проверки на координацию является тест, где больного просят дотронуться до носа. В случае развития заболевания человек не может нормально выполнить поставленную задачу. Пациент попадает то в рот, то в глаз. По почерку также видны негативные изменения: буквы написаны неравномерно, наползают друг на друга, прыгают по строке. Эти признаки свидетельствуют о неврологических проблемах.
При нарушении координации проявляются следующие симптомы:
Независимо от того, какой присутствует симптом, следует срочно обратиться к врачу. Доктор оценивает состояние пациента и точно устанавливает диагноз, на основании которого назначается терапевтическое воздействие. Раннее выявление нарушений в координации движений приводит к уменьшению симптоматики и непродолжительной терапии.
Лечение атаксии
Чтобы точно выявить заболевание, которым страдает пациент, доктор записывает жалобы, проводит внешний осмотр и тестирование. Для точности постановки диагноза необходимо пройти определенное обследование:
В зависимости от жалоб пациента диагностика подвергается корректировке, расширяется спектр необходимых анализов. Доктор на основе полученных результатов рассказывает, как и почему нужно лечиться.
Чтобы лечить нарушение координации движения, применяется комплексный подход, в который входит медикаментозная терапия, а так же при исключении противопоказаний- реабилитация.. Для терапии используют следующие медикаменты:
Все лекарственные средства назначаются доктором для больного в индивидуальном порядке.
Разработан ряд упражнений, призванных восстановить равновесие, а так же с целью профилактики их возникновений:
Благодаря ежедневным занятиям все системы постепенно приводятся в норму. Терапия лекарствами дополнительно воздействует на внутренние органы и приводит в норму кровообращение. Это позволяет быстро лечить приобретенную болезнь.
Таким образом, нарушение координации движения – патологический процесс, происходящий из-за сбоев в работе нервной системы. Симптоматика заболевания очевидна, поэтому не стоит затягивать с лечением. Правильно и ежедневно выполняемые упражнения, а также прием рекомендуемых препаратов позволяют быстро восстановить состояние пациента.
Публикации в СМИ
Иммунодефициты вторичные
ВТОРИЧНЫЕ ИММУНОДЕФИЦИТЫ ПРИ НАРУШЕНИЯХ БИОХИМИЧЕСКОГО ГОМЕОСТАЗА
Состояния, приводящие к хроническому дисбалансу гормонов, питательных веществ и токсичных продуктов метаболизма, могут оказывать выраженные эффекты на один или несколько компонентов иммунной системы. В настоящей статье рассмотрены некоторые заболевания и состояния, при которых часто возникает клинически значимая дисфункция иммунной системы.
Сахарный диабет • Дисфункция нейтрофилов у больных СД предрасполагает к грибковым инфекциям • Существует прямая зависимость между степенью гипергликемии и подавлением функций нейтрофилов • Недостаточность микроциркуляции приводит к изъязвлению кожных покровов и ограничению хемотаксиса нейтрофилов к месту внедрения микроорганизмов • Типичные инфекционные осложнения СД — диссеминированный кандидоз, зигомикозы (Absidia, Mortierella, Mucor, Rhizopus) носовой полости и лёгких, а также отит, вызванный Pseudomonas aeruginosa.
Диализ/почечная недостаточность • Пациенты, находящиеся на хроническом гемодиализе, характеризуются подавлением функций Т-лимфоцитов in vitro и in vivo (кожная анергия), угнетением синтеза АТ и активности нейтрофилов, снижением экспрессии и/или функции рецепторов к Fc-фрагменту IgG • Механизм иммунодепрессии при гемодиализе полностью не изучен. Некоторые из иммунных дефектов частично объясняют высоким уровнем эндогенных ГК и применением бионесовместимых диализных мембран, повреждающих клеточную адгезию и ослабляющих фагоцитарный ответ • У больных, длительно находящихся на перитонеальном диализе, в результате потери с диализатом опсонинов (иммуноглобулинов и компонентов комплемента) и прямого супрессивного действия диализата возникает недостаточность функций нейтрофилов брюшины. В совокупности указанные факторы объясняют повышенную частоту бактериальных перитонитов в этой группе больных.
Нефротический синдром. Снижение концентрации многих сывороточных факторов приводит к депрессии иммунной системы у больных с нефротическим синдромом.
• Потеря иммуноглобулинов и белков комплемента увеличивает частоту бактериальных инфекций. Потеря витамина D и сывороточных факторов роста и дифференцировки может вызывать депрессию клеточного иммунитета.
• Иммунодепрессанты, назначаемые по поводу основного заболевания, усугубляют дефицит антиинфекционной резистентности.
• Нарушение питания повышает заболеваемость и смертность от инфекций, вызываемых превалирующими для данного региона возбудителями. Например, смертность от пневмонии и гастроэнтерита увеличивается в 10 и 30 раз, соответственно. В Латинской Америке алиментарная недостаточность выступает в качестве кофактора для 60% летальных исходов вследствие инфекционных заболеваний.
ВТОРИЧНЫЕ ИММУНОДЕФИЦИТЫ ПРИ АУТОИММУННЫХ ЗАБОЛЕВАНИЯХ
Аутоиммунное заболевание и иммунодефицит часто сопутствуют друг другу. Как и при микробных инфекциях, умеренные изменения функции иммунной системы обнаруживают практически при всех аутоиммунных заболеваниях. Однако связь между ними и снижением иммунной защиты не так очевидна. Тем не менее при СКВ значение вторичных инфекций, связанных с иммунной дисфункцией, весьма существенно.
СКВ. Инфекции — основной фактор заболеваемости и смертности, а также главная причина летальных исходов 33% больных СКВ. Часто встречающиеся возбудители включают Staphylococcus aureus, E. coli, P. aeruginosa, Salmonella enteritidis, Streptococcus pneumoniae, Neisseria meningitidis, Listeria monocytogenes, Mycobacterium tuberculosis, Herpes zoster, Candida albicans, Cryptococcus neoformans, Pneumocystis carinii, Toxoplasma gondii. Регистрируемые иммунные дефекты зависят не только от применяемых иммунодепрессантов и отличаются межиндивидуальной гетерогенностью. При СКВ обнаружены дефекты практически в каждом звене иммунной системы.
• Т-клеточная (особенно CD4 + ) лимфопения.
• Подавление реакций ГЗТ, снижение ответа Т-лимфоцитов на Аг и митогены in vitro.
• Характерно увеличение количества периферических Т-лимфоцитов с фенотипом TCR a / b + CD4 – CD8 – (TCR — рецептор T-лимфоцитов, от англ. T cell receptor).
• Поликлональная активация В-лимфоцитов и гипергаммаглобулинемия (наблюдают также гипогаммаглобулинемию и дефицит субклассов IgA и/или IgG).
• Снижение содержания и активности NK-клеток.
• Подавление клеточно-опосредованного иммунного ответа in vitro и in vivo. Интенсивность гуморального ответа варьирует и зависит от Аг.
• Дисфункция макрофагов (снижение иммунного клиренса, Аг-представляющей функции, продукции цитокинов), возможно, вследствие образования аутоантител против рецепторов к Fc-фрагменту IgG.
• Нейтропения и подавление фагоцитарной активности нейтрофилов обусловлены, вероятно, аутоантителами к молекулам адгезии (увеличение клиренса клеток, хроническая аберрантная активация клеток с последующим сниженным ответом на физиологические стимулы).
• При СКВ аутоантитела класса IgM, реагирующие против Т-лимфоцитов, в значительной степени ответственны за депрессию Т-клеточной функции. Имеются сообщения о функциональной асплении в сочетании с сепсисом у больных СКВ.
Ревматоидный артрит. Стойкие изменения функций периферических Т-лимфоцитов при ревматоидном артрите отсутствуют. Имеются отдельные сообщения о незначительных дефектах иммунной защиты, например уменьшении количества цитотоксических Т-лимфоцитов, специфичных к вирусу Эпстайна–Барр, однако системного дефекта цитотоксической функции нет. Гуморальный ответ (на противогриппозную вакцину) и реакция ГЗТ при ревматоидном артрите не изменены.
ВТОРИЧНЫЕ ИММУНОДЕФИЦИТЫ, ОБУСЛОВЛЕННЫЕ СРЕДОВЫМИ ВОЗДЕЙСТВИЯМИ
Ультрафиолетовое облучение. УФ-лучи В спектра (УФ-В) — главный фактор риска рака кожи. Существует мнение, что рак кожи развивается не только вследствие прямого мутагенного действия УФ-лучей, но и в результате УФ-опосредованной супрессии иммунных функций кожи. При базально-клеточной карциноме или меланоме УФ-В подавляют индукцию контактной ГЗТ. Лабораторные животные после УФ-облучения характеризуются повышенной чувствительностью к инфекциям.
Токсические химические соединения. Появление новой дисциплины — иммунотоксикологии — свидетельствует об актуальности проблемы иммуноповреждающих эффектов ксенобиотиков. Некоторые из ксенобиотиков с доказанным или вероятным иммунотоксичным действием в отношении людей и животных перечислены ниже. Многие из этих соединений в той или иной степени угнетают костный мозг, подавляют функции Т-лимфоцитов in vivo (атрофия вилочковой железы, ГЗТ) и in vitro (ответ на митогены, Аг, смешанная культура лимфоцитов), вызывают поликлональную активацию В-лимфоцитов (проаутоиммунный эффект), увеличивают частоту инфекций (преимущественно респираторных), повышают риск злокачественных заболеваний (прямое мутагенное действие и/или угнетение функции иммунного надзора).
Химические соединения, приводящие к дисфункциям иммунной системы (По Faist E et al., World J Surg 1966, 20:454)
• Полициклические ароматические углеводороды •• Бензпирены: уменьшают образование АТ •• Бензантрацены: уменьшают активность цитотоксических T-лимфоцитов; канцерогены •• Бензол: вызывает лимфопению; канцероген.
• Полигалогенированные ароматические углеводороды •• Полихлорированные бифенилы: уменьшают активность T-лимфоцитов •• Полибромированные бифенилы: способствуют инфекциям дыхательных путей и лёгких •• полихлорированные дибензофураны, полихлорированные бензодиоксины: подавляют клеточный иммунитет.
• Ароматические амины •• Бензидин: подавляет клеточный иммунитет, канцероген (рак мочевого пузыря).
• Ксенобиотики с эффектами эстрогенов •• ДДТ (дихлордифенилтрихлорэтан): вызывает атрофию вилочковой железы •• Зеараленол: миелотоксикант •• Тетрагидроканнабинол: подавляет клеточный иммунитет •• Диэтилстильбэстрол: подавляет активность NK-клеток и образование АТ.
• Пестициды •• Хлорорганические соединения (в т.ч. ДДТ): вызывают лимфопению •• Фосфорорганические соединения: вызывают атрофию вилочковой железы, уменьшают активность T-лимфоцитов, подавляют образование АТ •• Метил изоцианат: увеличивает количество T-лимфоцитов, но подавляет их активность.
• Содержащие металлы органические соединения •• Органотины: вызывают атрофию вилочковой железы, уменьшают пролиферацию цитотоксических T-лимфоцитов •• Метилированная ртуть: угнетает систему комплемента •• диметилнитрозамин: подавляет образование АТ; канцероген.
• Тяжёлые металлы •• Мышьяк, кадмий, медь, золото, железо, свинец, цинк: подавляют костномозговые ростки, вызывают лимфопению; канцерогены •• Асбест: подавляет все виды иммунитета.
• Поллютанты воздуха •• Озон, диоксид серы: уменьшают сопротивляемость к респираторным инфекциям •• Диоксид азота: подавляет активность альвеолярных макрофагов.
• Токсины грибов •• Охратоксин: подавляет образование АТ •• Трихотецены: подавляют клеточный и гуморальный иммунитет.
• Разные •• Этанол: подавляет все виды и реакции иммунитета.
ВТОРИЧНЫЕ ИММУНОДЕФИЦИТЫ, СВЯЗАННЫЕ С ДРУГИМИ СОСТОЯНИЯМИ И ЗАБОЛЕВАНИЯМИ
Кишечная лимфангиэктазия — патологическое расширение лимфатических сосудов слизистой оболочки кишечника, приводящее к потере лимфы, иммуноглобулинов и лимфоцитов через просвет кишечника. Это врождённое заболевание или вторичное состояние, возникающее при обструкции дренирующих лимфатических протоков или повышении ЦВД.
• У больных с рецидивирующими инфекциями и низким содержанием в сыворотке крови IgG могут быть эффективны иммуноглобулины для внутривенного введения. Необходимы высокие дозы ввиду постоянных потерь иммуноглобулинов через кишечник.
Аспления/гипоспленизм. В селезёнке сосредоточено приблизительно 25% фагоцитарного потенциала организма. Она осуществляет иммунный клиренс слабо опсонизированных Аг (т.е. связавших недостаточные количества АТ или комплемента). Поэтому селезёнка приобретает важное значение при первичном и ранних этапах вторичного иммунного ответа на инфекционные Аг, когда высокоаффинные АТ в больших количествах ещё отсутствуют. В селезёнке происходит взаимодействие Т-лимфоцитов, Аг-представляющих клеток и В-лимфоцитов. Селезёнка — главное место активации В-лимфоцитов и важный источник сывороточного IgM.
• Аспления или гипоспленизм увеличивают риск генерализованных инфекций, возбудители которых имеют полисахаридную капсулу: S. pneumoniae, H. influenzae, N. meningitidis. Эти микроорганизмы резистентны к фагоцитозу, если не связаны с достаточным количеством IgG и комплемента.
• При асплении гуморальный ответ к этим и другим возбудителям снижен. Содержание в сыворотке крови IgM ниже нормы, уровень IgG варьирует, содержание IgA может быть повышено. Абсолютное содержание периферических В-лимфоцитов увеличено, в основном вследствие нарушения рециркуляции (кровоток–ткани) и хоминга. Аспления не повреждает клеточный иммунитет.
• При спленэктомии риск инфекции максимален в раннем послеоперационном периоде. Частота сепсиса у взрослых и детей (до 16 лет) без селезёнки составляет 0,9% и 4,2%, соответственно •• Пациентам старше 2 лет за 2 нед до спленэктомии назначают пневмококковую и менингококковую вакцины. Ревакцинацию пневмококковой вакциной проводят через 3–6 лет •• Всем больным показана антибиотикопрофилактика в течение как минимум 3 лет: феноксиметилпенициллин или амоксициллин по 125 мг 2 р/сут для детей младше 5 лет или по 250 мг 2 р/сут для лиц старше 5 лет. Альтернативный режим химиопрофилактики — ко-тримоксазол в суточной дозе 4–5 мг/кг однократно •• Для эмпирической терапии лихорадочных состояний применяют комбинированный препарат амоксициллин + клавулановая кислота.
Аллогенное переливание крови
• Трансфузия крови от донора, несовместимого по Аг главного комплекса гистосовместимости, увеличивает частоту послеоперационных инфекций на 30% и более. Объём перелитой аллогенной крови достоверно коррелирует с риском послеоперационной инфекции.
• При трансфузии лейкоредуцированной крови (истощение лейкоцитов) лабораторным животным проинфекционный эффект отсутствует. В экспериментальных моделях переливание крови вызывает ускорение опухолевого роста и увеличивает смертность.
• Всё большое распространение получает мнение о необходимости трансфузий лейкоредуцированной крови хирургическим и онкологическим пациентам, т.к. аллогенные лейкоциты сенсибилизируют реципиента (фебрильные негемолитические посттрансфузионные реакции), вызывают реакции «трансплантат против хозяина», иммунодепрессию и реактивацию вирусных инфекций.
Беременность. У беременных повышена частота инфекционных заболеваний, контролируемых клеточным иммунным ответом: гепатиты А, В, грипп, герпес, хламидиоз, кампилобактериоз, туберкулёз, грибковые, протозойные инфекции и гельминтозы. Депрессия клеточного иммунитета у беременных, очевидно, имеет физиологический смысл, т.к. позволяет уменьшить вероятность отторжения плода, экспрессирующего отцовские Аг. Имеют значение следующие этиологические факторы:
• Прогестерон подавляет пролиферацию лимфоцитов in vitro, может быть основным иммунодепрессором при беременности.
• Уромодулин — сывороточный фактор, специфичный для беременных, — ингибирует активность В-лимфоцитов, хотя гуморальный ответ при беременности в целом сохранён.
• Сниженный ответ Т-лимфоцитов на митогены наблюдают только в присутствии аутологичной сыворотки, что указывает на значение циркулирующих факторов супрессии.
• При неосложнённой беременности антибиотикопрофилактика банальных инфекций не рекомендована.
Старение. Иммунодефицит в старческом возрасте выражен умеренно, и тяжёлые оппортунистические инфекции (пневмоцистная пневмония, генерализованные грибковые инфекции) нетипичны. С наибольшей частотой возникают реактивация туберкулёза и инфекции, обусловленные вирусом varicella-zoster.
• Снижение секреторной активности слизистых оболочек, потеря эластичности тканей, вегетативная дисфункция способствуют увеличению частоты инфекций дыхательной и мочеполовой систем.
• Фагоцитарная активность (хемотаксис, фагоцитоз, внутриклеточный киллинг) может быть подавлена. Это объясняет меньшее повышение содержания в крови лейкоцитов при инфекциях у пожилых и приводит к незавершённому фагоцитозу.
• Снижение продукции провоспалительных цитокинов ограничивает температурную реакцию у пожилых.
• С возрастом увеличивается количество циркулирующих незрелых Т-лимфоцитов, что отражает нарушение тимус-зависимой дифференцировки вследствие инволюции вилочковой железы. У пожилых также снижен Т-клеточный ответ на митогены, аллоантигены и специфические Аг. Кожная реакция ГЗТ обычно подавлена или отсутствует. При инфицировании M. tuberculosis в возрасте до 55 лет анергию наблюдают в 10% случаев, в возрасте старше 55 лет — в 30%. Содержание Аг-представляющих клеток Лангерханса в коже пожилых снижено вдвое.
• По мере старения нарастает титр аутоантител, снижается титр специфических АТ; количество В-лимфоцитов существенно не меняется. По-видимому, снижение ответа на чужеродные Аг — результат недостаточной активности Т-хелперов, потому что ответ В-лимфоцитов на поликлональные активаторы (митогены, анти-Ig АТ) сохранён в достаточной степени. Вакцинация пожилых менее эффективна по сравнению с молодыми. Нет убедительных доказательств того, что аутореактивные элементы ответственны за развитие широкого круга патологических состояний у пожилых.
• Увеличение частоты злокачественных заболеваний при старении приписывают, по крайней мере отчасти, снижению иммунного надзора. Однако отчётливые доказательства этой связи отсутствуют.
Сокращение. TCR — рецептор T-лимфоцитов (от англ. T cell receptor).
МКБ-10 • D80 Иммунодефициты с преимущественной недостаточностью АТ • D81 Комбинированные иммунодефициты • D83 Обычный вариабельный иммунодефицит • D84 Другие иммунодефициты
Код вставки на сайт
Иммунодефициты вторичные
ВТОРИЧНЫЕ ИММУНОДЕФИЦИТЫ ПРИ НАРУШЕНИЯХ БИОХИМИЧЕСКОГО ГОМЕОСТАЗА
Состояния, приводящие к хроническому дисбалансу гормонов, питательных веществ и токсичных продуктов метаболизма, могут оказывать выраженные эффекты на один или несколько компонентов иммунной системы. В настоящей статье рассмотрены некоторые заболевания и состояния, при которых часто возникает клинически значимая дисфункция иммунной системы.
Сахарный диабет • Дисфункция нейтрофилов у больных СД предрасполагает к грибковым инфекциям • Существует прямая зависимость между степенью гипергликемии и подавлением функций нейтрофилов • Недостаточность микроциркуляции приводит к изъязвлению кожных покровов и ограничению хемотаксиса нейтрофилов к месту внедрения микроорганизмов • Типичные инфекционные осложнения СД — диссеминированный кандидоз, зигомикозы (Absidia, Mortierella, Mucor, Rhizopus) носовой полости и лёгких, а также отит, вызванный Pseudomonas aeruginosa.
Диализ/почечная недостаточность • Пациенты, находящиеся на хроническом гемодиализе, характеризуются подавлением функций Т-лимфоцитов in vitro и in vivo (кожная анергия), угнетением синтеза АТ и активности нейтрофилов, снижением экспрессии и/или функции рецепторов к Fc-фрагменту IgG • Механизм иммунодепрессии при гемодиализе полностью не изучен. Некоторые из иммунных дефектов частично объясняют высоким уровнем эндогенных ГК и применением бионесовместимых диализных мембран, повреждающих клеточную адгезию и ослабляющих фагоцитарный ответ • У больных, длительно находящихся на перитонеальном диализе, в результате потери с диализатом опсонинов (иммуноглобулинов и компонентов комплемента) и прямого супрессивного действия диализата возникает недостаточность функций нейтрофилов брюшины. В совокупности указанные факторы объясняют повышенную частоту бактериальных перитонитов в этой группе больных.
Нефротический синдром. Снижение концентрации многих сывороточных факторов приводит к депрессии иммунной системы у больных с нефротическим синдромом.
• Потеря иммуноглобулинов и белков комплемента увеличивает частоту бактериальных инфекций. Потеря витамина D и сывороточных факторов роста и дифференцировки может вызывать депрессию клеточного иммунитета.
• Иммунодепрессанты, назначаемые по поводу основного заболевания, усугубляют дефицит антиинфекционной резистентности.
• Нарушение питания повышает заболеваемость и смертность от инфекций, вызываемых превалирующими для данного региона возбудителями. Например, смертность от пневмонии и гастроэнтерита увеличивается в 10 и 30 раз, соответственно. В Латинской Америке алиментарная недостаточность выступает в качестве кофактора для 60% летальных исходов вследствие инфекционных заболеваний.
ВТОРИЧНЫЕ ИММУНОДЕФИЦИТЫ ПРИ АУТОИММУННЫХ ЗАБОЛЕВАНИЯХ
Аутоиммунное заболевание и иммунодефицит часто сопутствуют друг другу. Как и при микробных инфекциях, умеренные изменения функции иммунной системы обнаруживают практически при всех аутоиммунных заболеваниях. Однако связь между ними и снижением иммунной защиты не так очевидна. Тем не менее при СКВ значение вторичных инфекций, связанных с иммунной дисфункцией, весьма существенно.
СКВ. Инфекции — основной фактор заболеваемости и смертности, а также главная причина летальных исходов 33% больных СКВ. Часто встречающиеся возбудители включают Staphylococcus aureus, E. coli, P. aeruginosa, Salmonella enteritidis, Streptococcus pneumoniae, Neisseria meningitidis, Listeria monocytogenes, Mycobacterium tuberculosis, Herpes zoster, Candida albicans, Cryptococcus neoformans, Pneumocystis carinii, Toxoplasma gondii. Регистрируемые иммунные дефекты зависят не только от применяемых иммунодепрессантов и отличаются межиндивидуальной гетерогенностью. При СКВ обнаружены дефекты практически в каждом звене иммунной системы.
• Т-клеточная (особенно CD4 + ) лимфопения.
• Подавление реакций ГЗТ, снижение ответа Т-лимфоцитов на Аг и митогены in vitro.
• Характерно увеличение количества периферических Т-лимфоцитов с фенотипом TCR a / b + CD4 – CD8 – (TCR — рецептор T-лимфоцитов, от англ. T cell receptor).
• Поликлональная активация В-лимфоцитов и гипергаммаглобулинемия (наблюдают также гипогаммаглобулинемию и дефицит субклассов IgA и/или IgG).
• Снижение содержания и активности NK-клеток.
• Подавление клеточно-опосредованного иммунного ответа in vitro и in vivo. Интенсивность гуморального ответа варьирует и зависит от Аг.
• Дисфункция макрофагов (снижение иммунного клиренса, Аг-представляющей функции, продукции цитокинов), возможно, вследствие образования аутоантител против рецепторов к Fc-фрагменту IgG.
• Нейтропения и подавление фагоцитарной активности нейтрофилов обусловлены, вероятно, аутоантителами к молекулам адгезии (увеличение клиренса клеток, хроническая аберрантная активация клеток с последующим сниженным ответом на физиологические стимулы).
• При СКВ аутоантитела класса IgM, реагирующие против Т-лимфоцитов, в значительной степени ответственны за депрессию Т-клеточной функции. Имеются сообщения о функциональной асплении в сочетании с сепсисом у больных СКВ.
Ревматоидный артрит. Стойкие изменения функций периферических Т-лимфоцитов при ревматоидном артрите отсутствуют. Имеются отдельные сообщения о незначительных дефектах иммунной защиты, например уменьшении количества цитотоксических Т-лимфоцитов, специфичных к вирусу Эпстайна–Барр, однако системного дефекта цитотоксической функции нет. Гуморальный ответ (на противогриппозную вакцину) и реакция ГЗТ при ревматоидном артрите не изменены.
ВТОРИЧНЫЕ ИММУНОДЕФИЦИТЫ, ОБУСЛОВЛЕННЫЕ СРЕДОВЫМИ ВОЗДЕЙСТВИЯМИ
Ультрафиолетовое облучение. УФ-лучи В спектра (УФ-В) — главный фактор риска рака кожи. Существует мнение, что рак кожи развивается не только вследствие прямого мутагенного действия УФ-лучей, но и в результате УФ-опосредованной супрессии иммунных функций кожи. При базально-клеточной карциноме или меланоме УФ-В подавляют индукцию контактной ГЗТ. Лабораторные животные после УФ-облучения характеризуются повышенной чувствительностью к инфекциям.
Токсические химические соединения. Появление новой дисциплины — иммунотоксикологии — свидетельствует об актуальности проблемы иммуноповреждающих эффектов ксенобиотиков. Некоторые из ксенобиотиков с доказанным или вероятным иммунотоксичным действием в отношении людей и животных перечислены ниже. Многие из этих соединений в той или иной степени угнетают костный мозг, подавляют функции Т-лимфоцитов in vivo (атрофия вилочковой железы, ГЗТ) и in vitro (ответ на митогены, Аг, смешанная культура лимфоцитов), вызывают поликлональную активацию В-лимфоцитов (проаутоиммунный эффект), увеличивают частоту инфекций (преимущественно респираторных), повышают риск злокачественных заболеваний (прямое мутагенное действие и/или угнетение функции иммунного надзора).
Химические соединения, приводящие к дисфункциям иммунной системы (По Faist E et al., World J Surg 1966, 20:454)
• Полициклические ароматические углеводороды •• Бензпирены: уменьшают образование АТ •• Бензантрацены: уменьшают активность цитотоксических T-лимфоцитов; канцерогены •• Бензол: вызывает лимфопению; канцероген.
• Полигалогенированные ароматические углеводороды •• Полихлорированные бифенилы: уменьшают активность T-лимфоцитов •• Полибромированные бифенилы: способствуют инфекциям дыхательных путей и лёгких •• полихлорированные дибензофураны, полихлорированные бензодиоксины: подавляют клеточный иммунитет.
• Ароматические амины •• Бензидин: подавляет клеточный иммунитет, канцероген (рак мочевого пузыря).
• Ксенобиотики с эффектами эстрогенов •• ДДТ (дихлордифенилтрихлорэтан): вызывает атрофию вилочковой железы •• Зеараленол: миелотоксикант •• Тетрагидроканнабинол: подавляет клеточный иммунитет •• Диэтилстильбэстрол: подавляет активность NK-клеток и образование АТ.
• Пестициды •• Хлорорганические соединения (в т.ч. ДДТ): вызывают лимфопению •• Фосфорорганические соединения: вызывают атрофию вилочковой железы, уменьшают активность T-лимфоцитов, подавляют образование АТ •• Метил изоцианат: увеличивает количество T-лимфоцитов, но подавляет их активность.
• Содержащие металлы органические соединения •• Органотины: вызывают атрофию вилочковой железы, уменьшают пролиферацию цитотоксических T-лимфоцитов •• Метилированная ртуть: угнетает систему комплемента •• диметилнитрозамин: подавляет образование АТ; канцероген.
• Тяжёлые металлы •• Мышьяк, кадмий, медь, золото, железо, свинец, цинк: подавляют костномозговые ростки, вызывают лимфопению; канцерогены •• Асбест: подавляет все виды иммунитета.
• Поллютанты воздуха •• Озон, диоксид серы: уменьшают сопротивляемость к респираторным инфекциям •• Диоксид азота: подавляет активность альвеолярных макрофагов.
• Токсины грибов •• Охратоксин: подавляет образование АТ •• Трихотецены: подавляют клеточный и гуморальный иммунитет.
• Разные •• Этанол: подавляет все виды и реакции иммунитета.
ВТОРИЧНЫЕ ИММУНОДЕФИЦИТЫ, СВЯЗАННЫЕ С ДРУГИМИ СОСТОЯНИЯМИ И ЗАБОЛЕВАНИЯМИ
Кишечная лимфангиэктазия — патологическое расширение лимфатических сосудов слизистой оболочки кишечника, приводящее к потере лимфы, иммуноглобулинов и лимфоцитов через просвет кишечника. Это врождённое заболевание или вторичное состояние, возникающее при обструкции дренирующих лимфатических протоков или повышении ЦВД.
• У больных с рецидивирующими инфекциями и низким содержанием в сыворотке крови IgG могут быть эффективны иммуноглобулины для внутривенного введения. Необходимы высокие дозы ввиду постоянных потерь иммуноглобулинов через кишечник.
Аспления/гипоспленизм. В селезёнке сосредоточено приблизительно 25% фагоцитарного потенциала организма. Она осуществляет иммунный клиренс слабо опсонизированных Аг (т.е. связавших недостаточные количества АТ или комплемента). Поэтому селезёнка приобретает важное значение при первичном и ранних этапах вторичного иммунного ответа на инфекционные Аг, когда высокоаффинные АТ в больших количествах ещё отсутствуют. В селезёнке происходит взаимодействие Т-лимфоцитов, Аг-представляющих клеток и В-лимфоцитов. Селезёнка — главное место активации В-лимфоцитов и важный источник сывороточного IgM.
• Аспления или гипоспленизм увеличивают риск генерализованных инфекций, возбудители которых имеют полисахаридную капсулу: S. pneumoniae, H. influenzae, N. meningitidis. Эти микроорганизмы резистентны к фагоцитозу, если не связаны с достаточным количеством IgG и комплемента.
• При асплении гуморальный ответ к этим и другим возбудителям снижен. Содержание в сыворотке крови IgM ниже нормы, уровень IgG варьирует, содержание IgA может быть повышено. Абсолютное содержание периферических В-лимфоцитов увеличено, в основном вследствие нарушения рециркуляции (кровоток–ткани) и хоминга. Аспления не повреждает клеточный иммунитет.
• При спленэктомии риск инфекции максимален в раннем послеоперационном периоде. Частота сепсиса у взрослых и детей (до 16 лет) без селезёнки составляет 0,9% и 4,2%, соответственно •• Пациентам старше 2 лет за 2 нед до спленэктомии назначают пневмококковую и менингококковую вакцины. Ревакцинацию пневмококковой вакциной проводят через 3–6 лет •• Всем больным показана антибиотикопрофилактика в течение как минимум 3 лет: феноксиметилпенициллин или амоксициллин по 125 мг 2 р/сут для детей младше 5 лет или по 250 мг 2 р/сут для лиц старше 5 лет. Альтернативный режим химиопрофилактики — ко-тримоксазол в суточной дозе 4–5 мг/кг однократно •• Для эмпирической терапии лихорадочных состояний применяют комбинированный препарат амоксициллин + клавулановая кислота.
Аллогенное переливание крови
• Трансфузия крови от донора, несовместимого по Аг главного комплекса гистосовместимости, увеличивает частоту послеоперационных инфекций на 30% и более. Объём перелитой аллогенной крови достоверно коррелирует с риском послеоперационной инфекции.
• При трансфузии лейкоредуцированной крови (истощение лейкоцитов) лабораторным животным проинфекционный эффект отсутствует. В экспериментальных моделях переливание крови вызывает ускорение опухолевого роста и увеличивает смертность.
• Всё большое распространение получает мнение о необходимости трансфузий лейкоредуцированной крови хирургическим и онкологическим пациентам, т.к. аллогенные лейкоциты сенсибилизируют реципиента (фебрильные негемолитические посттрансфузионные реакции), вызывают реакции «трансплантат против хозяина», иммунодепрессию и реактивацию вирусных инфекций.
Беременность. У беременных повышена частота инфекционных заболеваний, контролируемых клеточным иммунным ответом: гепатиты А, В, грипп, герпес, хламидиоз, кампилобактериоз, туберкулёз, грибковые, протозойные инфекции и гельминтозы. Депрессия клеточного иммунитета у беременных, очевидно, имеет физиологический смысл, т.к. позволяет уменьшить вероятность отторжения плода, экспрессирующего отцовские Аг. Имеют значение следующие этиологические факторы:
• Прогестерон подавляет пролиферацию лимфоцитов in vitro, может быть основным иммунодепрессором при беременности.
• Уромодулин — сывороточный фактор, специфичный для беременных, — ингибирует активность В-лимфоцитов, хотя гуморальный ответ при беременности в целом сохранён.
• Сниженный ответ Т-лимфоцитов на митогены наблюдают только в присутствии аутологичной сыворотки, что указывает на значение циркулирующих факторов супрессии.
• При неосложнённой беременности антибиотикопрофилактика банальных инфекций не рекомендована.
Старение. Иммунодефицит в старческом возрасте выражен умеренно, и тяжёлые оппортунистические инфекции (пневмоцистная пневмония, генерализованные грибковые инфекции) нетипичны. С наибольшей частотой возникают реактивация туберкулёза и инфекции, обусловленные вирусом varicella-zoster.
• Снижение секреторной активности слизистых оболочек, потеря эластичности тканей, вегетативная дисфункция способствуют увеличению частоты инфекций дыхательной и мочеполовой систем.
• Фагоцитарная активность (хемотаксис, фагоцитоз, внутриклеточный киллинг) может быть подавлена. Это объясняет меньшее повышение содержания в крови лейкоцитов при инфекциях у пожилых и приводит к незавершённому фагоцитозу.
• Снижение продукции провоспалительных цитокинов ограничивает температурную реакцию у пожилых.
• С возрастом увеличивается количество циркулирующих незрелых Т-лимфоцитов, что отражает нарушение тимус-зависимой дифференцировки вследствие инволюции вилочковой железы. У пожилых также снижен Т-клеточный ответ на митогены, аллоантигены и специфические Аг. Кожная реакция ГЗТ обычно подавлена или отсутствует. При инфицировании M. tuberculosis в возрасте до 55 лет анергию наблюдают в 10% случаев, в возрасте старше 55 лет — в 30%. Содержание Аг-представляющих клеток Лангерханса в коже пожилых снижено вдвое.
• По мере старения нарастает титр аутоантител, снижается титр специфических АТ; количество В-лимфоцитов существенно не меняется. По-видимому, снижение ответа на чужеродные Аг — результат недостаточной активности Т-хелперов, потому что ответ В-лимфоцитов на поликлональные активаторы (митогены, анти-Ig АТ) сохранён в достаточной степени. Вакцинация пожилых менее эффективна по сравнению с молодыми. Нет убедительных доказательств того, что аутореактивные элементы ответственны за развитие широкого круга патологических состояний у пожилых.
• Увеличение частоты злокачественных заболеваний при старении приписывают, по крайней мере отчасти, снижению иммунного надзора. Однако отчётливые доказательства этой связи отсутствуют.
Сокращение. TCR — рецептор T-лимфоцитов (от англ. T cell receptor).
МКБ-10 • D80 Иммунодефициты с преимущественной недостаточностью АТ • D81 Комбинированные иммунодефициты • D83 Обычный вариабельный иммунодефицит • D84 Другие иммунодефициты
