С чем реагирует этен
Этилен (этен), получение, свойства, химические реакции
Этилен (этен), получение, свойства, химические реакции.
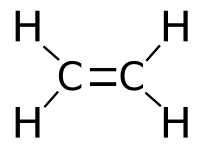
Этилен (этен), C2H4 – органическое вещество класса алкенов. Этилен имеет двойную углерод-углеродную связь и поэтому относится к ненасыщенным или непредельным углеводородам.
Этилен (этен), формула, газ, характеристики:
Химическая формула этилена C2H4, рациональная формула H2CCH2, структурная формула CH2=CH2. Изомеров не имеет.
Этилен – бесцветный газ, без вкуса, со слабым запахом. Легче воздуха.
Этилен является фитогормоном, т.е. низкомолекулярным органическим веществом, вырабатываемым растениями и имеющим регуляторные функции. Он образуется в тканях самого растения и выполняет в жизненном цикле растений многообразные функции, среди которых контроль развития проростка, созревание плодов (в частности, фруктов ), распускание бутонов (процесс цветения), старение и опадание листьев и цветков, участие в реакции растений на биотический и абиотический стресс, коммуникации между разными органами растений и между растениями в популяции.
Пожаро- и взрывоопасен.
Этилен по токсикологической характеристике относится к веществам 4-го класса опасности (малоопасным веществам) по ГОСТ 12.1.007.
Этилен — самое производимое органическое соединение в мире.
Физические свойства этилена (этена):
| Наименование параметра: | Значение: |
| Цвет | без цвета |
| Запах | со слабым запахом |
| Вкус | без вкуса |
| Агрегатное состояние (при 20 °C и атмосферном давлении 1 атм.) | газ |
| Плотность (при 20 °C и атмосферном давлении 1 атм.), кг/м 3 | 1,178 |
| Плотность (при 0 °C и атмосферном давлении 1 атм.), кг/м 3 | 1,26 |
| Температура плавления, °C | -169,2 |
| Температура кипения, °C | -103,7 |
| Температура вспышки, °C | 136,1 |
| Температура самовоспламенения, °C | 475,6 |
| Критическая температура*, °C | 9,6 |
| Критическое давление, МПа | 5,033 |
| Взрывоопасные концентрации смеси газа с воздухом, % объёмных | от 2,75 до 36,35 |
| Удельная теплота сгорания, МДж/кг | 46,988 |
| Коэффициент теплопроводности (при 0 °C и атмосферном давлении 1 атм.), Вт/(м·К) | 0,0163 |
| Коэффициент теплопроводности (при 50 °C и атмосферном давлении 1 атм.), Вт/(м·К) | 0,0209 |
| Молярная масса, г/моль | 28,05 |
* при температуре выше критической температуры газ невозможно сконденсировать ни при каком давлении.
Химические свойства этилена (этена):
Этилен — химически активное вещество. Так как в молекуле между атомами углерода имеется двойная связь, то одна из них, менее прочная, легко разрывается, и по месту разрыва связи происходит присоединение, замещение, окисление, полимеризация молекул.
Химические свойства этилена аналогичны свойствам других представителей ряда алкенов. Поэтому для него характерны следующие химические реакции:
Однако при нагревании этилена до температуры 300 o C разрыва двойной углерод-углеродной связи не происходит – реакция галогенирования протекает по механизму радикального замещения:
Реакция происходит в присутствии минеральных кислот (серной, фосфорной). В результате данной химической реакции образуется этанол.
Этилен легко окисляется. В зависимости от условий проведения реакции окисления этилена могут быть получены различные вещества: многоатомные спирты, эпоксиды или альдегиды.
В результате образуется эпоксид.
В результате образуется ацетальдегид.
Получение этилена (этена). Химические реакции – уравнения получения этилена (этена):
Этилен получают как в лабораторных условиях, так и в промышленных масштабах.
В промышленных масштабах этилен получается в результате следующей химической реакции:
Этилен в лабораторных условиях получается в результате следующих химических реакций:
Применение и использование этилена (этена):
Примечание: © Фото //www.pexels.com, //pixabay.com
как получить этилен реакция ацетилен этен 1 2 вещество этилен кислород водород связь является углекислый газ бромная вода
уравнение реакции масса объем полное сгорание моль молекула смесь превращение горение получение этилена
напишите уравнение реакций этилен
С чем реагирует этен
На нашем сайте собрано более 100 бесплатных онлайн калькуляторов по математике, геометрии и физике.
Основные формулы, таблицы и теоремы для учащихся. Все что нужно, чтобы сделать домашнее задание!
Не можете решить контрольную?!
Мы поможем! Более 20 000 авторов выполнят вашу работу от 100 руб!
Характеристики и физические свойства этена
Этен (этилен) – бесцветный горючий газ (строение молекулы показано на рис. 1), обладающий слабым запахом. Мало растворим в воде. Хорошо растворяется в диэтиловом эфире и углеводородах.
Рис. 1. Строение молекулы этилена.
Таблица 1. Физические свойства этена.
Молярная масса, г/моль
Температура плавления, o С
Температура кипения, o С
Получение этена
В промышленных объемах этен получают при переработке нефти: крекингом и дегидрированием этана. Лабораторные способы получения этилена представлены
— неполное гидрирование ацетилена
Химические свойства этена
Этен весьма реакционноспособоное соединение. Все химические превращения этилена протекают с расщеплением:
Применение этена
Основное направление использование этилена — промышленный органический синтез таких соединений как галогенопроизводные, спирты (этанол, этиленгликоль), уксусный альдегид, уксусная кислота и др. Кроме этого данное соединение в производстве полимеров.
Примеры решения задач
| Задание | В результате присоединения йода к этилену получено 98,7 г иодопроизводного. Рассчитайте массу и количество вещества этилена, взятого для реакции. |
| Решение | Запишем уравнение реакции присоединения йода к этилену: |
В результате реакции образовалось иодопроизводное – дийодэтан. Рассчитаем его количество вещества (молярная масса равна – 282 г/моль):
Согласно уравнению реакции n(C2H4I2) : n(C2H4) = 1:1, т.е. n(C2H4I2) = n(C2H4) = 0,35 моль. Тогда масса этилена будет равна (молярная масса – 28 г/моль):
| Задание | Рассчитайте объем этилена, приведенный к нормальным условиям, который можно получить из технического этилового спирта C2H5OH массой 300 г. Учтите, что технический спирт содержит примеси, массовая доля которых равна 8%. |
| Решение | Запишем уравнение реакции получения этилена из этилового спирта: |
Найдем массу чистого (без примесей) этилового спирта. Для этого сначала рассчитаем его массовую долю:
Определим количество вещества этилового спирта (молярная масса – 46 г/моль):
Согласноуравнениюреакцииn(C2H5OH) : n(C2H4) = 1:1, т.е. n(C2H5OH) = n(C2H4) = 3,83 моль. Тогда объем этилена будет равен:
Химические свойства Этена
При хлорировании этилена получается 1,2-дихлорэтан, гидратация приводит к этиловому спирту, взаимодействие с HCl – к этилхлориду. При окислении этилена кислородом воздуха в присутствии катализатора образуется окись этилена. При жидкофазном каталитическом окислении кислородом получается ацетальдегид, в тех же условиях в присутствии уксусной кислоты – винилацетат. Этилен является алкилирующим агентом, например, в условиях реакции Фриделя-Крафтса способен алкилировать бензол и другие ароматические соединения. Этилен способен полимеризоваться в присутствии катализаторов как самостоятельно, так и выступать в роли сомономера, образуя обширный ряд полимеров с различными свойствами.
Применение
Также полиэтилен применяют для производства ряда сополимеров, в том числе с пропиленом, стиролом, винилацетатом и другими. Этилен является сырьем для производства окиси этилена; как алкилирующий агент – при производстве этилбензола, диэтилбензола, триэтилбензола.
Этилен применяют как исходный материал для производства ацетальдегида и синтетического этилового спирта. Также он используется для синтеза этилацетата, стирола, винилацетата, хлористого винила; при производстве 1,2-дихлорэтана, хлористого этила.
Этилен используют для ускорения созревания плодов — например, помидоров, дынь, апельсинов, мандаринов, лимонов, бананов; дефолиации растений, снижения предуборочного опадения плодов, для уменьшения прочности прикрепления плодов к материнским растениям, что облегчает механизированную уборку урожая.
В высоких концентрациях этилен оказывает на человека и животных наркотическое действие.
А вот химические свойства:
Так как в молекулах алкенов содержится двойная связь, то одна из этих связей пи связь может легко разрыватся с образованием 2 свободных электронов, к этим электронам будут присоединятся другие атомы или группы атамов, тоесть для лкенов характерны реакции присоединения.
1) Гидрирование (реакция протекает при катализаторе, температуре)
2)Взаимодействие с галогенводородами
Правило Морковникова
При взаимодействии алкенов с молекулами содержащими Н и какой-нибудь другой атом или группу атомов Н будет присоединятся к тому атому углерода при двойной связи у которого его больше, а другой атом или группа атомов к соседнему углероду при 2 связи
3) Гидратация
4) Горение
Физические и химические свойства этилена
Формула – С2Н4 (СН2 = СН2). Молекулярная масса (масса одного моль) – 28 г/моль.
Химические свойства этилена
Для этилена характерны реакции, протекающщие по механизму электрофильного, присоединения, реакции радикального замещения, окисления, восстановления, полимеризации.
Галогенирование (электрофильное присоединение) — взаимодействие этилена с галогенами, например, с бромом, при котором происходит обесцвечивание бромной воды:
Галогенирование этилена возможно также при нагревании (300
Гидрогалогенирование — взаимодействие этилена с галогенводородами (HCl, HBr) с образование галогенпроизводных алканов:
Гидратация — взаимодействие этилена с водой в присутствии минеральных кислот (серной, фосфорной) с образованием предельного одноатомного спирта – этанола:
Среди реакций электрофильного присоединения выделяют присоединение хлорноватистой кислоты (1), реакции гидрокси- и алкоксимеркурирования (2, 3) (получение ртутьорганических соединений) и гидроборирование (4):
Реакции нуклеофильного присоединения характерны для производных этилена, содержащих электроноакцепторные заместители. Среди реакций нуклеофильного присоединения особое место занимают реакции присоединения циановодородной кислоты, аммиака, этанола. Например,
В ходе реакций окисления этилена возможно образование различных продуктов, причем состав определяется условиями проведения окисления. Так, при окислении этилена в мягких условиях (окислитель – перманганат калия) происходит разрыв π-связи и образование двухатомного спирта — этиленгликоля:
При жестком окислении этилена кипящим раствором перманганата калия в кислой среде происходит полный разрыв связи (σ-связи) с образованием муравьиной кислоты и углекислого газа:
Окисление этилена кислородом при 200
При восстановлении этилена происходит образование этана, представителя класса алканов. Реакция восстановления (реакция гидрирования) этилена протекает по радикальному механизму. Условием протекания реакции является наличие катализаторов (Ni, Pd, Pt), а также нагревание реакционной смеси:
Этилен вступает в реакцию полимеризации. Полимеризация — процесс образования высокомолекулярного соединения – полимера-путем соединения друг с другом с помощью главных валентностей молекул исходного низкомолекулярного вещества – мономера. Полимеризация этилена происходит под действием кислот (катионный механизм) или радикалов (радикальный механизм):
Физические свойства этилена
Этилен – бесцветный газ со слабым запахом, малорастворимый в воде, растворим в спирте, хорошо растворим в диэтиловом эфире. При смешении с воздухом образует взрывоопасную смесь
Получение этилена
Основные способы получения этилена:
— дегидрогалогенирование галогенпроизводных алканов под действием спиртовых растворов щелочей
— дегалогенирование дигалогенпроизводных алканов под действием активных металлов
— дегидратация этилена при его нагревании с серной кислотой (t >150 
— дегидрирование этана при нагревании (500
Применение этилена
Этилен является одним из важнейших соединений, производимых в огромных промышленных масштабах. Его используют в качестве сырья для производства целого спектра различных органических соединений (этанол, этиленгликоль, уксусная кислота и т.д.). Этилен служит исходным сырьем для производства полимеров (полиэтилен и др.). Его применяют в качестве вещества, ускоряющего рост и созревание овощей и фруктов.
Примеры решения задач
| Задание | Осуществите ряд превращений этан → этен (этилен) → этанол → этен → хлорэтан → бутан. |
| Решение | Для получения этена (этилена) из этана необходимо использовать реакцию дегидрирования этана, которая протекает в присутствии катализатора (Ni, Pd, Pt) и при нагревании: |
Получение этанола из этена осуществляют по реакции гидратации, протекающей водой в присутствии минеральных кислот (серной, фосфорной):
Для получения этена из этанола используют реакцию дегидротации:
Получение хлорэтана из этена осуществляют по реакции гидрогалогенирования:
Для получения бутана из хлорэтана используют реакцию Вюрца:
| Задание | Вычислите сколько литров и граммов этилена можно получить из 160 мл этанола, плотность которого равна 0,8 г/мл. |
| Решение | Этилен из этанола можно получить по реакции дегидратации, условием протекания которой является присутствие минеральных кислот (серной, фосфорной). Запишем уравнение реакции получения этилена из этанола: |
Найдем массу этанола:
Молярная масса (молекулярная масса одного моль) этанола, вычисленная с помощью таблицы химических элементов Д.И. Менделеева – 46 г/моль. Найдем количество вещества этанола:
Могласно уравнению реакции v(C2H5OH) : v(C2H4) = 1:1, следовательно, v(C2H4) = v(C2H5OH) = 2,78 моль. Молярная масса (молекулярная масса одного моль) этилена, вычисленная с помощью таблицы химических элементов Д.И. Менделеева – 28 г/моль. Найдем массу и объем этилена:
Этилен — структурная формула, химические свойства, применение
Характеристики этилена
Этилен, или этен, имеет структурную формулу C2 H4 и является простейшим представителем непредельных этиленовых углеводородов:


В обычных условиях данное органическое вещество является газом без цвета и запаха. А теперь можем перейти к главной теме — химическим свойствам этилена.
Главные химические свойства C2 H4
Изучение химических способностей этена будет разделено на отдельные блоки, в которых четко и детально будут расписаны подробности взаимодействий.
Реакции присоединения
Если для предельных органических соединений характерны реакции замещения, то для алкенов, в частности этилена, типичны реакции присоединения:


Реакция полимеризации
Полимеризация — это процесс соединения одинаковых простых молекул — мономеров, в более сложные — полимеры. Берется неограниченное количество молекул этилена, и при повышенных давлении и температуре, в присутствии катализатора образуется полиэтилен.
Важно! Обратите внимание, что в полиэтилене уже нет кратной связи, она разрывается в процессе реакции.
Реакции окисления
Реакция изомеризации
Данная реакция не может протекать с этиленом, потому что у него не существует изомеров.
Механизм реакции электрофильного замещения
Мы уже рассмотрели реакцию присоединения галогена к этилену. Но стоит отдельно рассказать о механизме данной реакции, который необходимо знать. В результате отталкивания от пи-связи этена в молекуле хлора происходит поляризация, благодаря которой один атом хлора становится частично положительно заряженным, а другой — частично отрицательно заряженным. Это приводит к смещению пи-связи и образованию пи-комплекса. 

Применение этилена
Почему мы выделяем этот вопрос при изучении химических свойств этилена? Потому что применение данного органического вещества основано на всех его химических свойствах:
Благодаря этой статье, вы изучили и подробно рассмотрели все химические реакции, которые характерны для этилена — простейшего представителя алкенов. Перед этим кратко узнали о строении этого органического соединения, что позволило более четко взглянуть на его химическую активность в различных взаимодействиях. Мы оценили важность и пользу этена, а также его необходимость в современной жизни человека. Чтобы закрепить изученный материал, рекомендуем вам пройти тест, расположенный ниже и посмотреть познавательное видео.