С чем реагирует cl2o7
Оксид хлора(VII)
| Оксид хлора(VII) | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | Оксид хлора(VII) |
| Химическая формула | Cl2O7 |
| Физические свойства | |
| Состояние (ст. усл.) | жидкость |
| Отн. молек. масса | 182,901 а. е. м. |
| Молярная масса | 182.901 г/моль |
| Термические свойства | |
| Температура плавления | −91,5 °C |
| Температура кипения | 82 °C |
| Температура разложения | 120 °C |
| Классификация | |
| Рег. номер CAS | [12015-53-1] |
Окси́д хло́ра(VII) (дихлорогептаоксид) Cl2O7, (хлорный ангидрид) — кислотный оксид.
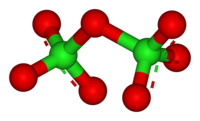
Молекула Cl2O7 имеет строение О3Cl—О—ClO3 (dCl—О = 0,1709 нм, в группах ClО3 — 0,1405 нм, угол ClOCl = 118,6°, ОClO 115,2°) c пространственной симметрией C2, молекула полярна (μ = 2,40·10 −30 Кл·м).
Свойства
Хлорный ангидрид представляет собой бесцветную маслянистую жидкость. Cl2O7 взрывается при нагревании выше 120 °C и от удара, однако он более устойчив, чем оксид и диоксид хлора. Жидкий Cl2О7 устойчив до 60—70 °C, но примесь низших оксидов хлора существенно ускоряет его распад:

Медленно растворяется в холодной воде, образуя хлорную кислоту:
Хлорный ангидрид является сильным окислителем.
Получение
Получают Cl2О7 при осторожном нагревании хлорной кислоты с фосфорным ангидридом или олеумом:
Оксид хлора(VII) получают также электролизом раствора НClО4 на платиновых электродах ниже 0 °C (Cl2O7 накапливается в анодном пространстве). Чистый Cl2O7 можно синтезировать также при нагревании в вакууме некоторых перхлоратов, например, Nb(ClO4)5 или МоО2(ClO4)2.
Литература
Полезное
Смотреть что такое «Оксид хлора(VII)» в других словарях:
Оксид хлора(I) — У этого термина существуют и другие значения, см. Оксид хлора. Оксид хлора(I) … Википедия
Хлора оксиды — Известны следующие оксиды хлора: Название Формула Температура плавления Температура кипения Цвет Оксид хлора(I) Cl2O 116 °C 2 °C от желтого до красноватого Оксид хлора(IV) ClO2 59 °C 11 °C желый,оранжево желтый Оксид хлора(VI) Cl2O6 3.5 °C … Википедия
Оксид — (окисел, окись) соединение химического элемента с кислородом, в котором сам кислород связан только с менее электроотрицательным элементом. Химический элемент кислород по электроотрицательности второй после фтора, поэтому к оксидам относятся… … Википедия
Оксид марганца(IV) — Общие … Википедия
Оксиды хлора — Известны следующие оксиды хлора: Название Формула Температура плавления Температура кипения Цвет Оксид хлора(I) Cl2O −116 °C 2 °C от жёлтого до красноватого Оксид хлора(IV) ClO2 −59 °C 11 °C жёлтый, оранжево жёлтый Оксид… … Википедия
Фторид рения(VII) — Общие … Википедия
Фторид хлора(I) — Фторид хлора(I) … Википедия
Фторид иода(VII) — Фторид иода(VII) … Википедия
Фторид хлора(III) — Фторид хлора(III) … Википедия
Фторид хлора(V) — (пентафторид хлора) ClF5, соединение хлора с фтором, представляющее собой при комнатной температуре бесцветный ядовитый тяжёлый газ с сильным раздражающим запахом. Конденсируется при охлаждении до −13 °C (или при увеличении давления) в … Википедия
Соединения хлора
Хлороводород, соляная кислота (HCl)
Способы получения хлороводорода
Промышленный способ:
Лабораторный способ:
В лаборатории HCl получают действием концентрированной H2SO4 на хлориды:
Физические свойства хлороводорода
HCl хорошо растворяется в воде: при обычной температуре в 1 л воды растворяется
450 л газа (реакция экзотермическая). Насыщенный раствор содержит 36-37 % HCl по массе, имеет резкий, удушающий запах.
Химические свойства хлороводорода
Газообразный HCl
Безводный НСl химически инертен по отношению к металлам, оксидам и гидроксидам металлов, а также ко многим другим веществам. Что означает, что в отсутствие воды хлороводород не проявляет кислотных свойств.
И только при очень сильном нагревании газообразный HCl реагирует с металлами, даже такими малоактивными, как Сu и Аg.
Восстановительные свойства HCl проявляются также в малой степени:
Раствор HCl
Водный раствор HCl является сильной кислотой, т.к. молекулы HCl практически полностью распадаются на ионы:
Общие свойства кислот
Он проявляет все свойства кислот:
Вступает в реакции с органическими соединениями:
с аминами:
с аминокислотами:
Кислородсодержащие кислоты галогенов
Хлорноватистая кислота (HClO) и ее соли
Хлорноватистая кислота очень слабая кислота и существует только в разбавленных водных растворах.
Получение хлорноватистой кислоты:
Химические свойства хлорноватистой кислоты:
HClO + KI → KIO3 + HCl
2HBr + HClO → HCl + Br2 + H2O
4HClO + MnS → 4HCl + MnSO4
HClO + KOH → KClO + H2O
3HClO → 2HCl + НСlO3
Химические свойства солей хлорноватистой кислоты (гипохлоритов):
NaClO + 2HCl → NaCl + Cl2 + H2O
Хлористая кислота (HClO2) и ее соли
Хлористая кислота HClO2– слабая кислота, существует только в водных растворах, очень неустойчива
Способы получения хлористой кислоты:
Химические свойства хлористой кислоты:
Соли хлористой кислоты – хлориты
Хлорноватая кислота (HClO3) и ее соли
Хлорноватая кислота HClO3– существует только в водных растворах, в свободном виде не выделена. Является сильной кислотой
Получение хлорноватой кислоты:
Действием кислот на хлораты:
Химические свойства хлорноватой кислоты:
Соли хлорноватой кислоты – хлораты:
Получают хлораты при пропускании хлора через подогретый раствор щелочи:
Хлорная кислота (HClO4) и ее соли
Хлорная кислота HClO4– летучая, хорошо растворимая в воде жидкость, не имеющая цвета. Является сильной кислотой и сильным окислителем. Взрывоопасна. Кислотный оксид — Cl2O7, соли хлорной кислоты — перхлораты.
Получение хлорной кислоты
Перегонкой при пониженном давлении смеси перхлората калия с серной кислотой:
Химические свойства хлорной кислоты
Химические свойства солей хлорной кислоты – перхлоратов:
Оксиды хлора
Оксид хлора (I), оксид дихлора ( Cl2O)
В газообразном состоянии имеет темно-желтый цвет, в жидком состоянии – красно-бурый. Неустойчив на свету при повышении температуры.
Получение оксид хлора (I)
Химические свойства оксида хлора (I)
Оксид хлора (IV), диоксид хлора, двуокись хлора ( ClO2)
ClO2 – ядовитый газ желто-зеленого цвета с резким запахом. Взрывается при механическом воздействии, при нагревании до 100 ºС и при контакте с восстановителем
Получение двуокиси хлора
В промышленности ClO2 получают, пропуская оксид серы (IV) через подкисленный раствор хлората натрия NaClO3:
В лаборатории ClO2получают при взаимодействии хлората калия с щавелевой кислотой в присутствии концентрированной серной кислоты:
Химические свойства оксида хлора (IV)
6ClO2 + 3H2O = HCl + 5HClO3 (горячая вода)
Оксид хлора (VI), триоксид хлора (ClO3 (Cl2O6))
ClO3 (Cl2O6) – вязкая жидкость красного цвета. Соприкосновение с органическими веществами приводит к взрыву.
Получение оксида хлора (VI)
Получают окислением озоном ClO2
Химические свойства оксида хлора (VI)
Оксид хлора (VII) (Cl2О7)
Cl2О7 – тяжелая, маслянистая жидкость, не имеющая цвета. Наиболее устойчивый из всех оксидов хлора. Очень взрывоопасен.
Получение оксида хлора (VII)
Получают при взаимодействии оксида фосфора (V) с концентрированной хлорной кислотой:
Химические свойства Cl2O7
Проявляет кислотные свойства.
Оксид хлорной кислоты (Cl2O7): формула, свойства, риски
Содержание:
В оксид хлорной кислоты, также называемый оксидом хлора (VII), хлорным ангидридом или дихлоргептоксидом, представляет собой неорганическое химическое соединение с формулой Cl2O7. Его структура представлена на рисунке 1.
Это один из самых стабильных оксидов хлора, который реагирует с водой с образованием хлорной кислоты: Cl2ИЛИ7 + H2O D 2HClO4.
Соединение перегоняют, чтобы отделить его от метафосфорной кислоты с большой осторожностью, учитывая его взрывоопасный характер. Он также может быть образован при освещении в смесях хлора и озона.
Физико-химические свойства оксида хлорной кислоты
Он самопроизвольно взрывоопасен при ударе или контакте с пламенем, особенно в присутствии продуктов его разложения.
Гептоксид хлора растворяется в четыреххлористом углероде при комнатной температуре и реагирует с водой с образованием хлорной кислоты. Взрывается при контакте с йодом.
В нормальных условиях он более стабилен, хотя и обладает меньшей окислительной способностью, чем другие оксиды хлора. Например, он не повреждает серу, фосфор или бумагу в холодном состоянии.
Его термическое разложение происходит за счет мономолекулярной диссоциации триоксида хлора и радикала.
Реакционная способность и опасности
Он самопроизвольно взрывоопасен, особенно в присутствии продуктов его разложения, несовместим с восстановителями, сильными кислотами и основаниями.
Хотя это самый стабильный оксид хлора, Cl2ИЛИ7 Это сильный окислитель, а также взрывчатое вещество, которое можно потушить пламенем, механическим ударом или контактом с йодом.
Однако он менее окисляет, чем другие оксиды хлора, и не разрушает серу, фосфор или бумагу в холодном состоянии. Имеет такое же действие на организм человека, как элементарный хлор, и требует тех же мер предосторожности.
Проглатывание вызывает сильные ожоги рта, пищевода и желудка. Пар очень токсичен при вдыхании.
В случае попадания в глаза проверьте, носите ли вы контактные линзы, и немедленно снимите их. Глаза следует промывать проточной водой в течение не менее 15 минут, держа веки открытыми. Можно использовать холодную воду. Глазную мазь использовать нельзя.
Если химическое вещество попало на одежду, удалите его как можно быстрее, защищая свои руки и тело. Поместите пострадавшего под защитный душ.
Если химическое вещество накапливается на открытой коже жертвы, например, на руках, загрязненную кожу осторожно и осторожно промывают проточной водой с неабразивным мылом.
Можно использовать холодную воду. Если раздражение не проходит, обратитесь за медицинской помощью. Перед повторным использованием вымойте загрязненную одежду.
В случае вдыхания пострадавшему следует дать отдохнуть в хорошо проветриваемом помещении. В случае тяжелого вдыхания пострадавшего следует как можно скорее эвакуировать в безопасное место.
Ослабьте тесную одежду, такую как воротник, пояс или галстук. Если пострадавшему трудно дышать, следует ввести кислород.
Если пострадавший не дышит, проводится реанимация «рот в рот». Всегда помните, что для человека, оказывающего помощь, может быть опасно реанимация «рот в рот», если вдыхаемый материал токсичен, заразен или вызывает коррозию.
В любом случае немедленно обратитесь за медицинской помощью.
Приложения
Оксид хлорной кислоты не имеет практического применения. Его можно использовать в качестве окислителя или для производства хлорной кислоты, но его взрывоопасная природа затрудняет обращение с ним.
Дихлоргептоксид можно использовать как реагент для производства перхлоратов или для исследования с различными реакциями.
В работе Курта Баума реакции перхлорной окиси с олефинами (Baum, 1976), спиртами (Kurt Baum, Reactions of dichlorine heptoxide with alcohols, 1974), алкилйодидов и ацилперхлората со сложным эфиром (Kurt Baum, 1975) с получением галогенирований и окислений.
В случае спиртов он производит алкилперхлораты путем реакции с простыми спиртами, такими как этиленгликоль, 1,4-бутадиенол, 2, 2, 2-трифторэтанол, 2, 2-динитропропанол. Реагирует с 2-пропанолом с образованием изопропилперхлората. 2-гексанол и 3-гексанол дают неупорядоченные перхлораты и их соответствующие кетоны.
Пропен реагирует с дихлоргептозидом в четыреххлористом углероде с образованием изопропилперхлората (32%) и 1-хлор, 2-пропилперхлората (17%). Соединение реагирует с СНГ-бутен с образованием 3-хлорбутилперхлората (30%) и 3-кето, 2-бутилперхлората (7%).
Дихлоргептоксид реагирует с первичными и вторичными аминами в растворе четыреххлористого углерода с образованием N-перхлоратов:
2 RNH2 + Cl2O7 → 2 RNHClO3 + H2O
2 R2NH + Cl2O7 → 2 R2NClO3 + H2O
Он также реагирует с алкенами с образованием алкилперхлоратов. Например, он реагирует с пропеном в растворе четыреххлористого углерода с образованием изопропилперхлората и 1-хлор-2-пропилперхлората (Beard & Baum, 1974).




 ΔH = 135 кДж/моль
ΔH = 135 кДж/моль