пристеночный кальциноз аорты что это такое
В настоящее время аортальный стеноз вследствие возникшего сужения аортального клапана является основным показанием для его протезирования во развитых странах, в том числе и в Красноярске. Несмотря на то, что происходит снижение количества случаев ревматической болезни сердца, из-за старения населения и возникновения атеросклероза у этой группы пациентов, кальциноз клапана стал самой частой проблемой сердечных клапанов в западных странах. Он выявляется приблизительно у 25% взрослых старше 65 лет, из которых 2-3% имеют клинически значимый аортальный стеноз. Даже кальциноз клапана легкой степени ассоциируется с неблагоприятными исходами, и соотноситься с 50% увеличением риска заболеваний сердечно-сосудистой системы. Не существует известных методов лечения, которые замедляют прогрессирование заболевания, и хирургическая замена клапана является единственным эффективным методом лечения аортального стеноза. Более 85000 замена аортального клапана операции делаются в Соединенных Штатах, и более 275000 выполняются по всему миру. Это число, как ожидается, утроится к 2050 году. Указанные выше статистические данные подчеркивают тяжесть заболевания аортального клапана и необходимости понимания ее механизмов, раннее выявление как клинически, так и с использованием неинвазивной эхокардиографии.
Кальциноз аортального клапана является прогрессирующим заболеванием, которое начинается с начальными изменениями в клеточной биологии створки клапана, которые развиваются подобно атеросклеротическому поражению аорты, как и склероз, и в конце концов приводит к кальцификации клапана, вызывая обструкцию оттока крови из выходного тракта левого желудочка. Хотя кальциноз аортального клапана по данных эхокардиографии прогрессирует с возрастом, он не всегда является неизбежным следствием старения. Дело в том, что кальциноз аортального клапана традиционно считался дегенеративным явлением, за длительные годы жизни человека происходят многочисленные механические воздействия на изначально нормальный клапан. Это вызывает оседание кальция на поверхности створки аортального клапана. Однако эволюционирующая концепция, что кальциноз аортального клапана активно регулируется, а значит процесс нельзя охарактеризовать просто как «старение» или «дегенерация». Прогрессивный процесс кальцификации включает в себя накопление липидов, увеличивая количество ангиотензин-превращающего фермента, активность воспаления, неоваскуляризацию и деградацию внеклеточного матрикса.
Надо учесть, что факторы риска кальциноза аортального клапана аналогичны таковым, которые относятся к появлению атеросклероза: возраст, пол, гиперхолестеринемия, сахарный диабет, курение, почечная недостаточность, гипертония. Более того, в патоморфологических исследованиях из извлеченных при протезировании стенотических аортальных клапанов человека были выявлены поражения, похожими на те, что и в атеросклеротических бляшках, которые содержат воспалительные клетки и при отложениях холестерина. Большое значение повышенного уровня холестерина подтверждается исследованиями на ЭхоКГ, демонстрирующих, что у больных с семейной гиперхолестеринемией развиваются поражения аортального клапана в виде кальцификации, которые усиливаются с возрастом. Кроме того, доклинические исследования показали атеросклеротические поражения створок аортального клапана как при атеросклерозе у кроликов и мышей с высоким уровнем холестерина. Из того, что кальциноз створок аортального клапана и атеросклероз может возникать подобным механизмом, то некоторые кардиологи считают, что статины могут включаться в потенциальную терапия для лечения кальциноза аортального клапана. Действительно, ретроспективные исследования с использованием эхокардиографии продемонстрировали уменьшение в прогрессировании заболевания, когда пациенты принимали статины. Кроме того, исследования на животных подтвердили, что лечение статинами сдерживает кальцификацию клапана. Большие проспективные клинические испытания, однако четко не показало, замедление прогрессирования кальциноза аортального клапана у пациентов, получавших высокие дозы статинов. Это может быть из-за позднего внедрения статинов в терапию, после того, ка кальцификация аортального клапана прогрессирует в необратимую стадию.
Аортальный клапан состоит из эндотелиальных клеток и интерстициальных клеток, которые поддерживают здоровье клапаном и их изменения важны в развитии порока сердца. Клапанные интерстициальные клетки, вероятно, опосредуют развитие кальциноза клапана. Какие биологические сигналы аортального клапана запускают активацию, дифференцировку, или патологические изменения пока неясны. Однако, мы знаем, что при кальцинозе аортального клапана, его интерстициальные клетки дифференцируются в миофибробласты и остеобласто-подобные клетки, которые в конечном итоге отвечает за отложение кальция. Патологические триггеры включают гемодинамические напряжения сдвига соединительной ткани, напряжение активных форм кислорода (АТФ), воспалительные цитокины и факторы роста, и физиологический дисбаланс, такие как метаболический синдром, сахарный диабет, терминальная стадия почечной недостаточности, и дисбаланс кальция или фосфата. Клеточные и молекулярные факторы, участвующие в развитии стеноза аортального клапана, однако, остаются в значительной степени неясными. Неблагоприятный прогноз и повышение смертности после появления симптомов дают обоснование для будущих исследований в достижении лучшего понимания процесса заболевания, которые могут привести к эффективным терапевтическим стратегиям для предотвращения кальциноза аортального клапана. В этой статье мы обсуждали современное понимание патофизиологии, факторы риска, клеточные механизмы, диагностики и клинического ведения кальциноза аортального клапана, и описывает направления дальнейших исследований жизненно важное значение для диагностики, лечения, что потенциально предотвращало бы это заболевание.
Кальциноз коронарных артерий
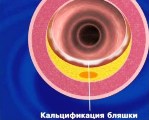
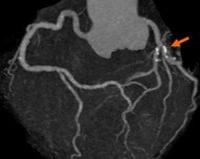
Кальциноз коронарных артерий — это отложение солей кальция в стенке сосудов, которые приносят артериальную кровь к миокарду. Болезнь длительное время характеризуется бессимптомным течением. Клинические проявления (боль в сердце, слабость, головокружения) возникают спустя несколько лет от начала кальцификации. Для диагностики коронарного кальциноза назначают инструментальные методики визуализации: электронно-лучевую и мультиспиральную КТ, внутрикоронарное УЗИ, коронарографию. Лечебные мероприятия включают терапию основного заболевания, коронарное стентирование, прием статинов и гормональных препаратов.
МКБ-10
Общие сведения
Кальциноз коронарных (венечных) артерий — независимый фактор риска развития острого коронарного синдрома. Точная распространенность этого состояния неизвестна. По данным выборочных исследований доказано, что среди здоровых женщин в возрасте после 40 лет кальциноз сосудов сердца встречается в 11,2% случаев. Среди мужчин распространенность патологии выше. Коронарный кальциноз часто сочетается с кальцинозом аорты и артерий внутренних органов.
Причины
В современной кардиологии ведутся дискуссии по поводу этиологических факторов кальциноза. Установлено, что отложение кальциевых солей может начинаться у людей молодого возраста (20-30 лет), не имеющих никаких сердечно-сосудистых болезней. Причины подобных бессимптомных изменений не установлены. У пациентов среднего и старшего возраста кальцификацию артерий связывают с атеросклеротическими изменениями сосудов.
Факторы риска
Среди факторов риска кальциноза выделяют необратимые и обратимые. К необратимым относят мужской пол, пожилой возраст и наличие в семье случаев сердечно-сосудистой патологии. Среди обратимых (управляемых) выделяют дислипидемию, воспалительные изменения сосудистой стенки, несбалансированное питание с дефицитом нутриентов. Гиповитаминоз Д считается одним из основных управляемых факторов, поскольку при недостатке холекальциферола нарушаются процессы кальциевого обмена.
Патогенез
Ученые считают, что кальциноз коронарных артерий — активный и обратимый процесс, который по механизму развития схож с реакциями костеобразования. Основную роль в отложении кальциевых солей в сосудах играют белки костного матрикса, которые по направленности действия подразделяются на 2 группы: ингибиторы и индукторы кальцификации. Эти протеины находятся в костной ткани, стенках артерий, липидных бляшках.
К индукторам кальциноза относят костную щелочную фосфатазу и костные метаболические белки. Они повышают концентрацию кальция, других минеральных соединений в интиме коронарных артерий, усиливают локальный воспалительный процесс. Среди ингибиторов кальцификации выделяют остеопонтин, остеопротегерин и фетуин-А. Кальциноз артерий провоцируется нарушением равновесия между этими группами регуляторных белков.
Симптомы
Кальциноз сосудов продолжительное время протекает бессимптомно. Клинические признаки кальцификации возникают в случае обширного поражения коронарных артерий, сопровождающегося ишемией миокарда. Симптомы также появляются при присоединении других сердечно-сосудистых заболеваний. Типичный возраст манифестации симптоматики — 45-50 лет. Патогномоничных признаков кальциноза коронарных сосудов не существует.
Чаще всего больные испытывают различные по характеру боли в прекардиальной области — ноющие, колющие, сжимающие. Болевой синдром провоцируется физической нагрузкой, сильными эмоциональными переживаниями. Реже боли ощущаются покое. Длительность болевых ощущений составляет от нескольких минут до часов и даже дней. Иногда больные описывают свои симптомы как давление и дискомфорт за грудиной.
Отмечаются неспецифические признаки: повышенная утомляемость, снижение работоспособности. При одновременном поражении других артерий беспокоит головокружение, снижается память — это последствия хронической гипоксии мозга. Кальциноз коронарных артерий зачастую сочетается со сниженной плотностью костной ткани и остеопорозом. Это обуславливает дополнительные проявления: беспричинные боли в костях и суставах, снижение физической активности.
Осложнения
Кальциноз венечных артерий — предиктор развития сердечно-сосудистых кризов. В ходе наблюдений обнаружено, что влияние кальцификации сосудов наиболее заметно у больных со средним риском инфаркта по шкале SCORE. Согласно исследованиям, около 20% пациентов после обнаружения кальциевых бляшек в сосудах переводятся в группу высокого и очень высокого риска. У таких людей риск смерти от сердечных причин увеличивается до 10% и больше.
Кальцификация атеросклеротических бляшек значительно повышает вероятность их разрыва под давлением крови. Покрышка бляшки в месте ее соединения с нормальной стенкой артерии становится очень тонкой и уязвимой. При нарушениях целостности бляшки липидные конгломераты могут закупоривать просвет одной из коронарных артерий, что приводит к некрозу участка миокарда.
Диагностика
Стандартный физикальный осмотр с аускультацией сердца малоинформативен для выявления коронарного кальциноза. В начале обследования врач-кардиолог назначает общеклинические анализы крови и мочи для быстрого скрининга состояния организма, исключения воспалительных заболеваний и патологий системы кроветворения. Диагностика кальциноза венечных артерий включает следующие методы:
Лечение кальциноза коронарных артерий
Консервативная терапия
Учитывая неясные этиопатогенетические механизмы развития заболевания, возникают трудности с подбором медикаментозного лечения. Зачастую кальциноз диагностируется на этапе присоединения других кардиологических болезней, поэтому терапия подбирается с учетом полного диагноза. В зависимости от степени поражения сердца назначают антиангинальные, гиполипидемические, антиаритмические препараты.
Хирургическое лечение
Для устранения крупных кальцификатов применяются методы интервенционной кардиологии — малоинвазивные хирургические вмешательства. Наилучшие результаты показывает коронарное стентирование — расширение просвета пораженной артерии с помощью специальных сетчатых имплантов. Методика отличается коротким реабилитационным периодом и минимальной травматичностью.
Экспериментальное лечение
Хотя утвержденных кардиологических протоколов лечения кальциноза коронарных артерий пока нет, но в медицинской литературе опубликованы результаты многочисленных исследований этой проблемы. Существует теория об эффективности статинов для уменьшения объема кальцинированных бляшек. Эта гипотеза получила подтверждение в двойных слепых плацебо-контролируемых испытаниях.
Женщинам после 50 лет с выявленным венечным кальцинозом рекомендованы препараты эстрогенов. Половые гормоны оказывают кардиопротективное действие, нормализуют кальциевый обмен и предотвращают дальнейшее повреждение коронарных сосудов. Активно обсуждается эффективность растительных и витаминных препаратов для улучшения метаболизма миокарда.
Прогноз и профилактика
Коронарный атеросклероз не опасен для пациентов, у которых нет других факторов риска, поэтому в подобных случаях прогноз обычно благоприятен. Благодаря методам малоинвазивной кардиохирургии удается устранить участки кальциноза и улучшить прогноз у страдающих сочетанными поражениями сердечно-сосудистой системы. Меры профилактики идентичны таковым, что применяются для предотвращения атеросклероза, другой кардиососудистой патологии.
Пристеночный кальциноз аорты что это такое
ФГБУ «Национальный медицинский исследовательский центр кардиологии» Минздрава России, Москва, Россия
ФГБУ «Национальный медицинский исследовательский центр кардиологии» Минздрава России, Москва, Россия
Московский областной НИИ акушерства и гинекологии
ФГБУ «Национальный медицинский исследовательский центр кардиологии» Минздрава России, Москва, Россия
ФГБУ «Национальный медицинский исследовательский центр кардиологии» Минздрава России, Москва, Россия
ФГБУ «Национальный медицинский исследовательский центр кардиологии» Минздрава России, Москва, Россия
ФГБУ «Национальный медицинский исследовательский центр кардиологии» Минздрава России, Москва, Россия
Кальциноз коронарных артерий и аорты у больных с высоким риском развития сердечно-сосудистых осложнений и сниженной минеральной плотностью костной ткани
Журнал: Кардиологический вестник. 2018;13(1): 23-29
Бланкова З. Н., Самсонова Н. С., Баринова И. В., Федотенков И. С., Шария М. А., Терновой С. К., Агеев Ф. Т. Кальциноз коронарных артерий и аорты у больных с высоким риском развития сердечно-сосудистых осложнений и сниженной минеральной плотностью костной ткани. Кардиологический вестник. 2018;13(1):23-29.
Blankova Z N, Samsonova N S, Barinova I V, Fedotenkov I S, Shariya M A, Ternovoy S K, Ageev F T. Coronary and aortic calcification in high cardiovascular risk patients with low bone mineral density. Russian Cardiology Bulletin. 2018;13(1):23-29.
https://doi.org/10.17116/Cardiobulletin201813123-29
ФГБУ «Национальный медицинский исследовательский центр кардиологии» Минздрава России, Москва, Россия
Цель исследования. Изучение взаимосвязи процессов атеросклероза и остеопороза (ОП). Материал и методы. Обследовали 86 больных (средний возраст 65 лет, высокий риск развития сердечно-сосудистых осложнений — ССО) с атеросклерозом брахиоцефальных артерий без ишемической болезни сердца. Проведены биохимический анализ крови, оценены уровни 25-гидроксивитамина D (25(ОН)D), остеопротегерина (ОПГ), выполнено исследование жесткости артериальной стенки (ЖАС) по данным аппланационной тонометрии и объемной сфигмографии, кальциевого индекса (КИ) по результатам мультиспиральной компьютерной томографии коронарных артерий (КА) и грудного отдела аорты, проведен сравнительный анализ полученных данных. По результатам двухэнергетической рентгеновской абсорбциометрии (DEXA) больных разделили на 3 группы: Т-критерий >–1 SD — нормальная МПКТ (n=18), T-критерий от –1 до –2,5 SD — остеопения (n=48) и Т-критерий ≤–2,5 SD — ОП (n=20). Результаты. У больных с высоким риском развития ССО не выявлено взаимосвязи частоты и выраженности кальциноза КА (ККА) и кальциноза грудного отдела аорты (КГОА) с наличием и тяжестью снижения минеральной плотности костной ткани. ККА и КГОА аорты статистически значимо чаще встречался у больных более старшего возраста, с более высокими параметрами ЖАС (скорость пульсовой волны на плече-лодыжечном сегменте — СПВпл), уровня ОПГ (для КА на уровне тенденций; р=0,07), риска больших переломов и переломов шейки бедренной кости (р
Выявленные взаимосвязи кальциноза артерий и ОП послужили стимулом для проведения большого количества работ, посвященных поиску общих механизмов развития этих заболеваний. В 2014 г. в Научно-диспансерном отделе НМИЦ кардиологии МЗ РФ выполнена работа, в которой изучались распространенность и выраженность ККА и кальциноза аорты у женщин из групп низкого и умеренного риска развития ССО при постменопаузальном ОП. В этом исследовании не выявлено взаимосвязи частоты и выраженности ККА и грудного отдела аорты и снижением МПКТ [18]. Представляется также интересным и актуальным проведение подобного исследования у больных с высоким риском развития ССО.
Цель настоящей работы — оценка частоты развития и выраженности ККА и кальциноза грудного отдела аорты (КГОА), их взаимосвязи с параметрами ЖАС у больных из группы высокого риска развития ССО и нарушением минерального обмена костной ткани.
Материал и методы
В открытое сравнительное исследование включали пациентов в возрасте от 50 до 75 лет с высоким риском развития ССО по шкале SCORE (более 5%), атеросклерозом брахиоцефальных артерий и снижением МПКТ. Пациенты с нормальной МПКТ составили группу контроля. Пациентам проведено комплексное обследование сердечно-сосудистой системы на базе Научно-диспансерного отдела Национального медицинского исследовательского центра кардиологии: общеклиническое обследование, биохимический анализ крови, исследование уровней 25-гидроксивитамина D (25 (ОН)D) и паратиреоидного гормона (ПТГ), ОПГ, а также аппланационная тонометрия, объемная сфигмография, двухэнергетическая рентгеновская абсорбциометрия (DEXA), мультиспиральная компьютерная томография коронарных (МСКТ) артерий (КА) и грудного отдела аорты. В исследование не включали больных с ИБС, перенесших нарушение мозгового кровообращения, транзиторные ишемические атаки, а также имеющих вторичные причины ОП, сахарный диабет, принимающих лекарственные препараты, которые влияют на костный обмен, и статины в течение последних 6 мес. Биохимическое исследование крови выполнено на селективном анализаторе Architect C8000 («Abbot», США), включало определение общего холестерина (ОХС), холестерина (ХС) липопротеидов низкой плотности (ЛПНП), ХС липопротеидов высокой плотности (ЛПВП), уровня триглицеридов (ТГ), кальция, фосфора, креатинина с расчетом скорости клубочковой фильтрации (СКФ) по формуле MDRD. Содержание 25 (ОН)D, ПТГ в плазме крови определяли иммунохимическим методом с электрохемолюминисцентной детекцией (ECLIA) на анализаторе ELECSYS 2010. Концентрацию ОПГ в сыворотке крови определяли методом иммуноферментного анализа (ELISA) у всех 68 больных с нарушением МПКТ и у 5 больных с нормальной МПКТ. Аппланационную тонометрию для определения параметров центрального давления (систолического — САД, диастолического — ДАД и пульсового — ПАД в аорте, индекса аугментации — ИА) и скорости пульсовой волны на каротидно-феморальном сегменте (СПВкф), отражающей жесткость аорты, выполняли на приборе Sphygmocor («AtcorMedical», Австралия) с использованием высококачественного аппланационного датчика Millar по стандартной методике (прямой способ измерения дистанции · 0,8). Скорость пульсовой волны на плечелодыжечном сегменте (СПВпл) измеряли при объемной сфигмографии, которую выполняли на приборе VaseraVS-1000 («FukudaDenshi», Япония). DEXA шейки бедренной кости (ШБК) и поясничного отдела позвоночника для определения МПКТ осуществляли на аппарате HologycDiscovery (США) по стандартной методике. Согласно Российским рекомендациям по диагностике и лечению ОП, диагноз «остеопении» устанавливали при Т-критерии МПКТ в поясничном отделе позвоночника или ШБК от –1 до –2,5 SD, ОП — при Т-критерии –2,5 SD и ниже. Т-критерий в пределах до –1 SD от пиковой костной массы соответствовал нормальной МПКТ. Для определения кальциевого индекса (КИ) КА и грудного отдела аорты проводили МСКТ на 64-спиральном компьютерном томографе («Toshiba Aquilion», Япония) с использованием стандартной укладки пациента на базе отдела томографии НМИЦ кардиологии (рук. — акад. РАН, проф. С.К. Терновой). КИ КА и грудного отдела аорты оценивали от корня аорты (выше отхождения КА) до верхушки сердца по стандартной методике. Расчет К.И. выполняли по Агатсону, используя специальное компьютерное обеспечение. У каждого пациента КИ в КА и грудном отделе аорты определяли для области кальцинированного участка, если его плотность составляла более 130 HU. При КИ=0 констатировали отсутствие кальциноза аорты и ККА.
Статистические расчеты проводили с помощью программного пакета Statistica 8.0. Основные параметры из-учаемых показателей представлены в виде медианы и значений нижнего (25%) и верхнего (75%) квантилей. Нормальным принимали распределение, у которого критерий отличия Колмогорова—Смирнова от теоретически нормального распределения Гаусса по значимости был более 0,05. Сравнение двух групп осуществляли с помощью критерия Манна—Уитни. Ассоциации между переменными выявляли с помощью коэффициента корреляции Спирмена. Различия при р 
Уровень ОПГ не различался в сравниваемых группах, составив в группе с нормальной МПКТ 4,7 (3,9; 4,7) пмоль/л, с остеопенией 4,9 (3,9; 7) пмоль/л и с ОП 5,0 (4,2; 6,3) пмоль/л. При корреляционном анализе наблюдалась взаимосвязь уровня ОПГ с Т-критерием МПКТ в поясничном отделе позвоночника у обследованных больных (r=–0,28; p 
Наличие и тяжесть нарушения минерального обмена костной ткани не повлияли на распространенность и выраженность ККА и КГОА (табл. 3).

Пациенты с ККА по сравнению с больными без такового были статистически значимо старше и имели более высокие центральные САД и ПАД, САД на плечевой артерии и ЖАС, оцененную с помощью СПВпл, в том числе по показателю, не зависящему от уровня АД, — CAVI (cardio-ankle vascular index) — сердечно-лодыжечный сосудистый индекс, а также более высокий риск больших переломов и переломов ШБК (табл. 4).

Наличие кальциноза аорты ассоциировалось с более старшим возрастом, более высокими СПВпл, CAVI, уровнем ОПГ, меньшей СКФ и, кроме того, с риском больших переломов и переломов ШБК (табл. 5).

В общей группе больных наблюдались положительные корреляции между выраженностью ККА и возрастом, уровнями САД на плечевой артерии и аорте, аортального ПАД, показателями ЖАС — СПВпл и CAVI. В группе больных с остеопенией, кроме указанных взаимосвязей, выявлена корреляция КИ в КА с СПВкф. Подобные взаимосвязи с изучаемыми параметрами центрального АД и ЖАС прослеживались и для тяжести кальциноза аорты. Выраженность ККА была тем больше, чем ниже был уровень содержания 25 (ОН)D в крови. У больных с ОП тяжесть ККА была взаимосвязана с более высокими уровнями паратгормона (r=–0,45; p 

Обсуждение
В проведенном исследовании не выявлено различий по частоте обнаружения и выраженности ККА и КГОА между больными с нормальной и сниженной МПКТ. Как отмечено ранее, в работах, в которых оценивалась такая взаимосвязь, обнаруживались противоречивые данные. Вероятно, это обусловлено разным контингентом больных и особенностями используемых методов оценки кальциноза. В нашей работе на наличие ККА и КГОА большое влияние оказал возраст больных. Кроме того, больные с ККА отличались от пациентов с некальцинированным коронарным руслом более высокими уровнями САД на плечевой артерии и на аорте и аортального ПАД и ЖАС. Такие взаимосвязи вполне ожидаемы, поскольку именно возраст и наличие артериальной гипертонии в многочисленных исследованиях проявили себя как важнейшие факторы риска ККА и кальциноза аорты [19].
Повышенная ЖАС в нашем исследовании коррелировала не только с наличием, но и с выраженностью ККА. В работе Я.А. Орловой и соавт. [20] показано, что ЖАС ассоциируется с тяжестью коронарного атеросклероза у мужчин с ИБС, а СПВпл являлась независимым маркером стенозирующего атеросклероза К.А. Важно, что ЖАС у больных с ОП в нашем исследовании была выше, чем у больных с нормальной МПКТ. Подобные данные получены ранее и у других исследователей в разных группах больных, в том числе у женщин с умеренным и низким риском развития ССЗ, а также у пациенток с ИБС и тяжелым ОП [21, 22].
Хотя в нашем исследовании отсутствовала явная зависимость ККА и кальциноза аорты от МПКТ, обращает внимание наличие взаимосвязей с параметрами, участвующими в минеральном обмене костной ткани: уровнем ОПГ, витамина D. Выраженность и наличие кальциноза аорты у наших больных были взаимосвязаны с концентрацией ОПГ, а более высокая его концентрация в группе с ККА определялась на уровне тенденций. Ассоциация уровня ОПГ со степенью кальциноза абдоминального отдела аорты также показана у больных, находящихся на гемодиализе [23]. В последние годы ученые не случайно уделяют большое внимание роли ОПГ в развитии ССЗ. Выявлена ассоциация повышенных уровней ОПГ в крови с развитием ИБС и ростом сердечно-сосудистой летальности [24]. Уровень ОПГ у обследованных нами пациентов был также взаимосвязан с Т-критерием МПКТ в поясничном отделе позвоночника. В работе A. Ozkok и соавт. [25] при обследовании женщин в постменопаузе выявлена ассоциация полиморфизма гена ОПГ с уровнем МПКТ.
Выявленная у наших больных корреляция тяжести ККА с меньшим содержанием витамина D в крови также отмечена у других исследователей [26]. При этом известно, что дефицит витамина D сопровождается повышением риска развития инфаркта миокарда, инсульта, сердечной недостаточности и смертности от них [27]. Функция витамина D в регуляции минерального обмена крайне велика. Витамин D непосредственно воздействует на абсорбцию кальция в кишечнике и на дифференцировку остеобластов и остеокластов. Это объясняет его влияние как на процессы костеобразования, так и на резорбцию костной ткани. Рецепторы к витамину D имеются также в ГМКС. При этом показано, что не только дефицит витамина D, но и прием его в высоких дозах способен стимулировать кальцификацию сосудов [28].
Представляется важным, что наличие и тяжесть кальциноза аорты у наших больных отрицательно коррелировали со СКФ. В исследовании CRIC также продемонстрирована независимая от других факторов ассоциация ККА с СКФ [29]. При этом известно, что снижение СКФ крайне неблагоприятно влияет на прогноз ССЗ, и даже ранние субклинические стадии нарушения функции почек являются независимым фактором риска развития ССО и смерти. Кардиоренальные взаимодействия, в частности, механизмы влияния почек на процессы атеро- и артериосклероза подробно изучены. Для хронической болезни почек типично развитие кальциноза артерий. Ремоделирование сосудистой стенки у больных хронической болезнью почек связано с изменениями, возникающими на фоне нарушения минерального обмена (дефицит витамина D, гиперпаратиреоз, гиперфосфатемия), а также анемии, воспаления, дисфункции эндотелия, активации симпатико-адреналовой и ренин-ангиотензин-альдостероновой систем [30].
Заключение
Наличие и тяжесть снижения минеральной плотности костной ткани у больных из группы высокого риска развития сердечно-сосудистых осложнений не повлияли на частоту выявления и выраженность кальциноза коронарных артерий и грудного отдела аорты. Факторами, влияющими на частоту и интенсивность кальцификации артерий в изучаемой группе больных, были возраст, уровень артериального давления, жесткость артериальной стенки, концентрация остеопротегерина и витамина D, скорость клубочковой фильтрации.
Авторы заявляют об отсутствии конфликта интересов.
Сведения об авторах
Самсонова Нарине Самвеловна — аспирант научно-диспансерного отдела
Баринова Ирина Владимировна — к.м.н., м.н.с. научно-диспансерного отдела
Федотенков Игорь Сергеевич — к.м.н., с.н.с. научно-диспансерного отдела
Шария Мераб Арчилович — д.м.н., проф., в.н.с. отд. томографии
Терновой Сергей Константинович — академик РАН, рук. отд. томографии
Агеев Фаиль Таипович — д.м.н., проф., науч. рук. научно-диспансерного отдела