преморбидный фон это что такое
Факторы риска преморбидного фона у детей с неотложными состояниями
Тверской государственный медицинский университет
Введение. Установлено [3, 6, 8, 12], что неблагоприятный акушерский анамнез, пренатальный, перинатальный, постнатальный периоды и раннего детского возраста способствуют накоплению факторов риска в преморбидном фоне [3, 5, 6, 13] и развитию у детей различных заболеваний. Кроме того, наличие нескольких факторов риска может не только резко ухудшить состояние здоровья ребенка, но и критически осложнить течение заболевания [1, 6, 7, 11].
Значимость преморбидного фона выявлена у детей при острой респираторно-вирусной инфекции [8] и отмечено, что худшее состояние наблюдается у больных с вирусной диареей при отягощенном преморбидном состоянии [6]. При комплексной оценке состояния здоровья и медико-социального статуса семей у детей с наследственной отягощенностью по гипертонической болезни [9] выявлены такие факторы риска, как курение родителей, низкая двигательная активность, наследственная отягощенность по эрготропным заболеваниям: ишемическая болезнь сердца, сахарный диабет, инфаркт миокарда, нейроциркуляторная дистония.
У матерей этой группы отмечена наибольшая частота патологии беременности и родов, у детей часто наблюдались острые инфекционные заболевания на 1-м году жизни и выявлялись хронические заболевания. При этом их родители имели более высокий образовательный уровень и более интенсивный уровень информационных нагрузок (интернет, телевидение).
В целом проведенное исследование [9] свидетельствует о необходимости разработки профилактических программ на семейном уровне при обнаружении артериальной гипертензии и ее факторов риска хотя бы у одного члена семьи. Доказано [5], что у детей с затяжным течением обструктивного бронхита выздоровление затягивается при наличии аллергологического анамнеза и на фоне анемии. По мнению авторов [5] для оценки генеза заболевания и оценки состояния ребенка на начальном этапе заболевания важно использовать интегральные гематологические показатели без применения специальных исследований.
Установлена роль преморбидного фона [3] в формировании фенотипа астмы у детей, страдающих бронхиальной астмой. Дети, рожденные в семьях с нарушениями репродуктивной системы [4], имели аномалии развития, врожденные пороки. Изучен [8] преморбидный фон у детей с рецидивирующими и хроническими заболеваниями бронхолегочной системы и отмечено, что к этим болезням приводят пассивное курение, асфиксия в родах, острая респираторно-вирусная инфекция и перенесенный бронхит в неонатальном периоде.
Отмечено неблагоприятное влияние факторов преморбидного фона [10] на функциональную активность фагоцитов у детей, больных пневмонией, у которых заболевание протекало на фоне железодефицитной анемии легкой и средней степени тяжести, рахита, гипотрофии 1-2 степени и аллергического диатеза в виде аллергодерматита. Полученные результаты позволяют авторам утверждать о негативном влиянии сопутствующей фоновой патологии на функциональную деятельность фагоцитов крови и, как следствие, на клиническое течение острой и затяжной пневмонии.
При исследовании [12] вредного пренатального и постнатального воздействия табачного дыма на организм детей было установлено увеличение частоты развития у них бронхиальной астмы и хронического бронхита. Такой подход к изучению преморбидного фона у детей требует осуществления раннего формирования групп риска и проведения своевременной профилактики с целью предупреждения у них не только развития заболеваний, но и связанных с ними неотложных состояний.
Целью исследования стало оценить частоту и характер факторов риска преморбидного фона в структуре неотложных состояний у детей при различных заболеваниях.
Для характеристики преморбидного фона детей использовали специальную анкету-опросник. В нее вошли данные акушерского анамнеза (беременность по счету, угроза прерывания, гестоз 1-й и 2-й половины беременности) матери пациента и ее соматического анамнеза (наличие анемии, острой респираторно-вирусной инфекции, пиелонефрита во время беременности). В анкету были включены вопросы, характеризующие родовой период (какие роды являлись по счету, срочные роды, стремительные роды, естественным путем или путем кесарева сечения), а также данные перинатального периода детей (показатели массы тела и роста ребенка при рождении, наличие задержки и аномалии внутриутробного развития плода), данные периода грудного возраста и раннего детства (естественное, смешанное или искусственное вскармливание, наличие аллергических реакций на продукты питания и медикаменты).
Статистическую обработку проводили с использованием пакета программы «StatSoft Statistica versio 6.0», «Biostat». Данные представлены в виде М (средняя величина)±SD (стандартное отклонение). Нормальность распределения оценивали по критерию Шапиро-Уилка. В зависимости от нормальности распределения при сравнении количественных показателей применяли t-критерий Стъюдента, критерий Вилкоксона, χ 2 [2].
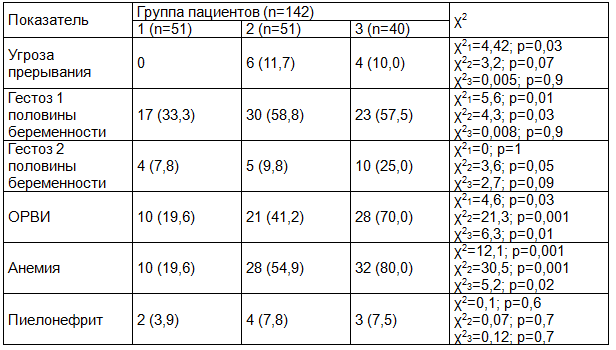
Факторы риска акушерского и соматического анамнеза у матерей представлены в табл. 1. Отмечено, что угроза прерывания беременности не наблюдалась у матерей 1-й группы и ее частота не различалась у пациентов 2-й и 3-й группы.
Гестоз 1-й половины беременности в 1-й группе отмечался у 1/3 матерей, во 2-й и 3-й группе его частота выявления не различалась и наблюдалась более чем у половины матерей.
Гестоз 2-й половины беременности выявляли существенно реже, чем гестоз 1-й половины и чаще в 3-й группе пациентов, чем в 1-й и 2-й.
Анализ соматического анамнеза матери показал, что острую респираторно-вирусную инфекцию во время беременности чаще переносили матери 2-й группы, чем 1-й, и наиболее часто матери 3-й группы.
Анемия беременных регистрировалась чаще у матерей 2-й группы, чем в 1-й и наиболее часто в 3-й группе, по отношению ко 2-й и 1-й группе.
Частота пиелонефрита беременных в 1-й, 2-й и 3-й группе статистически значимо не различалась.
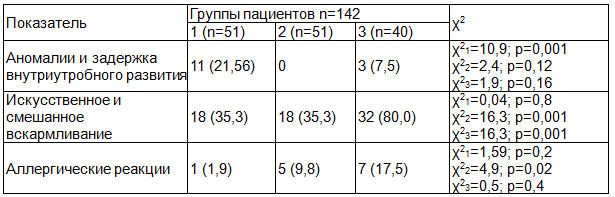
Анализ факторов риска у детей в перинатальном периоде представлен в табл. 2. Установлено, что аномалии и задержка внутриутробного развития преимущественно наблюдались в 1-й группе пациентов. Во 2-й группе таких больных не было вовсе. В 3-й группе аномалии и задержка внутриутробного развития выявлены в 3-х случаях, что было меньше, чем в 1-й группе.
Отмечено, что пациенты 1-й и 2-й группы одинаково часто получали искусственное и смешанное вскармливание и составляли менее половины от числа всех детей (18,0%). В 3-й группе искусственное и смешанное вскармливание получали 80,0% детей.
Частота аллергических реакций статистически значимо не различалась, при этом наблюдалась тенденция к их повышению, так во 2-й группе они наблюдались чаще, чем в 1-й группе и в 3-й группе чаще, чем во 2-й.
Таблица 1. Факторы риска акушерского и соматического анамнеза у матерей пациентов с ургентными состояниями, абс., %
Таблица 2. Факторы риска перинатального и раннего детского периода у пациентов с неотложными состояниями, абс., %
Можно полагать, что факторы акушерского и соматического анамнеза оказывают влияние на преморбидный фон детей и способствуют появлению различных заболеваний с развитием критических состояний.
Полученные результаты позволяют высказать предположение, что у детей в структуре неотложных состояний при заболеваниях воспалительного и невоспалительного генеза изученные факторы оказывают влияние на преморбидный фон и являются факторами риска для здоровья детей. Все это позволяет, как можно раньше, сразу после рождения, включать детей с аномалиями и задержкой внутриутробного развития, родившихся от третьей беременности и от матерей перенесших гестоз 1-й половины, в группу риска воспалительных заболеваний бронхолегочной системы и проводить раннюю профилактику. В группу риска травматических повреждений включать детей, родившихся от первой беременности, находившихся на искусственном и смешанном вскармливании, матери которых перенесли гестоз 1-й половины беременности и анемию. В группу риска геморрагических кровотечений (тромбоцитопенической пурпуры) относить детей, родившихся от второй беременности, получающих искусственное и смешанное вскармливание, имеющих частые аллергические реакции в анамнезе, матери которых во время беременности переносили анемию, острые респираторно-вирусные инфекции и гестоз 1-й половины.
Заключение. Проведение стратификации факторов преморбидного фона в структуре неотложных состояний у пациентов установило, что сочетание нескольких факторов акушерского, соматического анамнеза матери, перинатального и раннего детского возраста способствуют росту патологии у детей. Изученные факторы риска преморбидного фона необходимо учитывать на этапе поликлинического наблюдения за детьми, при разработке профилактических мер и формировании групп риска развития пневмонии, травм и тромбоцитопенической пурпуры у детей. В этом направлении необходимы дальнейшие исследования.
Преморбидный фон это что такое
Б. С. Беляев (1989) установил, что при монополярных разновидностях течения аффективного психоза — депрессивном и маниакальном значительно чаще, чем при отчетливо биполярном типе, встречались лица с шизоидными чертами в преморбиде (70,8 % и 61,6 % против 34,2 %) и реже гипертимный склад личности (24,3 % и 28,2 % против 53,8 % — при биполярном типе течения).
Согласно наблюдениям ОЛ. Борисовой (1989), присущие больным аффективным психозом личностные особенности в совокупности с их динамикой в ходе онтогенеза складывались в качественно различные картины доманифестных состояний, определяющих условия развития разновидностей течения болезни. В одних случаях структура личности больных аффективным психозом представлена примерно равным количеством шизоидных, гипертимных и тревожно-мнительных личностей. Данным лицам изначально свойственна конституционально обусловленная реактивная лабильность в виде аффективных реакций на неблагоприятные внешние причины. Обнаруживалась аффективная лабильность, выражающаяся в спонтанно возникающих кратковременных колебаниях настроения. Такие особенности личностной динамики с учетом целостной клинической характеристики проявлений доманифестного периода позволяют говорить об акцентуированных или психопатических личностях. В других случаях клиническая картина доманифестных состояний определяется в первую очередь наличием явлений дефицитарности в какой-либо сфере психической деятельности. В их личностных проявлениях преобладают недостаточность собственно эмоций, консерватизм личности; психические реакции больных отличаются ригидностью, монотонностью и однообразием. В картине пубертатного криза здесь часто впервые выявляются признаки нажитой соматореактивной лабильности. Она проявляется развитием аффективных и аффективно-невротических состояний и сменяется аутохтонно возникающими фазовыми состояниями, свидетельствующими об определенной эндогенизации расстройств. По совокупности личностных особенностей и их динамики данные состояния отличаются от психопатических и имеют большее сходство с выраженными аномалиями личности, описываемыми у больных шизофренией или у их родственников как псевдопсихопатические. О А. Борисова также отмечает, что доманифестные состояния по типу личностных акцентуаций и психопатических свойств чаще встречаются при отчетливо биполярном типе аффективного психоза и при биполярном психозе с преобладанием какого-либо одного полюса аффективных нарушений. Псевдопсихопатические доманифестные состояния описаны как преобладающие в доманифестном периоде монополярного (как депрессивного, так и маниакального) эндогенного аффективного психоза.
Преморбидный фон это что такое
К.Д. Ермоленко (1, 4), Н.В. Гончар (1, 2, 3), Ю.В. Лобзин (1, 2, 3)
1) Детский научно-клинический центр инфекционных болезней, Санкт-Петербург, Россия; 2) Северо-Западный государственный медицинский университет им. И.И. Мечникова, Санкт-Петербург, Россия; 3) Военно-медицинская академия им. С.М. Кирова, Санкт-Петербург, Россия; 4) Санкт-Петербургский НИИ эпидемиологии и микробиологии им. Пастера, Санкт-Петербург, Россия
Введение
Тенденцией последнего времени все отчетливее становится рост числа функциональных гастроинтестинальных расстройств (ФГИР) у реконвалесцентов тяжелых и среднетяжелых форм кишечных инфекций [1]. В настоящий момент ФГИР занимают лидирующее положение в структуре заболеваний органов пищеварения у детей различного возраста. По немногочисленным данным, распространенность этой патологии в развитых странах среди детей в возрасте от 4 до 18 лет составляет от 14 до 24% [2, 3]. Результаты эпидемиологических исследований в нашей стране свидетельствуют о том, что жалобы, характерные для данной группы заболеваний, предъявляют примерно 6% учащихся младших и 14% – старших классов, а также не менее 50% детей с рецидивирующим абдоминальным болевым синдромом [4].
При этом заболеваемость кишечными инфекциями, в первую очередь вирусной этиологии, в детском возрасте в значительной мере превосходит частоту распространения ФГИР. Так, у детей младшего возраста доля острых вирусных кишечных инфекций (ОВКИ) в структуре всех инфекционных диарей достигает 56,5–77,4% [5, 6], среди которых не менее половины приходится на ротавирусную [7] и около четверти – на норовирусную инфекции [8]. В большинстве случаев ОВКИ характеризуют как «самолимитирующие» заболевания, обычно заканчивающиеся выздоровлением через 5–14 дней на фоне адекватного патогенетического лечения. Данное утверждение справедливо в отношении легких форм вирусных диарей. Что же касается среднетяжелых и тяжелых ОВКИ у детей, то в подобных случаях имеются данные, свидетельствующие о возможности формирования постинфекционных ФГИР [9].
В связи с этим несомненный научный интерес представляет установление патогенетических механизмов и факторов, предрасполагающих к формированию ФГИР у реконвалесцентов ОВКИ. Расширение наших представлений в данной области позволило бы разработать методы прогнозирования высокого риска формирования постинфекционных ФГИР у детей для своевременного проведения лечебно-оздоровительных (реабилитационных) мероприятий и обеспечения оптимального качества жизни. В предшествовавших работах по изучению качества жизни с использованием опросников QUALIN у реконвалесцентов ОВКИ в возрасте от 1 года до 3 лет нами было установлено значимое его снижение у детей с сформировавшимися ФГИР в ближайшие 6–12 месяцев после болезни [10].
Среди факторов риска возникновения ФГИР у реконвалесцентов ОВКИ отдельные авторы выделяют женский пол, пищевые «погрешности», неблагоприятные социальные факторы, частое использование антибактериальных препаратов в лечении острой респираторной патологии [11, 12]. Определенную роль в формировании постинфекционных ФГИР играют трудновыявляемые при опросах родителей и родственников детей с ОВКИ факторы «психоэмоционального риска»: напряженные отношения в семье, плохие материально-бытовые условия жизни, социальная депривация и т.п. [13, 14].
К настоящему времени практически отсутствуют исследования, в которых были бы представлены результаты длительного катамнестического наблюдения детей в возрасте от 1 года до 7 лет после ОВКИ в сопоставлении с неблагоприятными особенностями анамнеза жизни для выявления их возможного влияния на развитие постинфекционных ФГИР.
Целью нашего исследования было на основании изучения анамнестических данных определить значимость неблагоприятных параметров преморбидного фона в формировании ФГИР у детей с ОВКИ.
Методы
Проведено проспективное динамическое исследование по типу «случай–контроль».
Исследование выполнено в 2014–2016 гг. в отделе кишечных инфекций ФГБУ ДНКЦИБ ФМБА России (Санкт-Петербург), а также в Клинико-диагностическом медицинском центре ФБУН НИИ ЭИМ им. Пастера Роспотребнадзора (Санкт-Петербург).
В ходе выполнения работы проведено комплексное клинико-лабораторное обследование 143 детей в возрасте от 1 года до 7 лет, перенесших ОВКИ рота- (РВИ), норовирусной (НВИ) и сочетанной ротаноровирусной (РНВИ) этиологии. Данные о половом и возрастном составе исследованных нозологических групп представлены в табл. 1. Группы детей были сопоставимыми по возрасту (H=0,89; p=0,64) и полу (χ2=1,44; p=0,47).
Выделены две возрастные группы детей: от 1 года до 3 лет («toddlers», младшая возрастная группа; n=95; 66,4%) и от 4 до 7 лет («child», старшая возрастная группа; n=48; 33,6%).
Отбор больных для исследований осуществлен методом случайной выборки. В исследование включены дети от 1 года до 7 лет с клинически и лабораторно подтвержденной ОВКИ. Диагноз верифицировали по данным исследований фекалий методом ПЦР с применением набора реагентов «АмплиСенс ОКИ скрин-FL» (Россия). Критерии включения в исследование: отсутствие органической или функциональной патологии органов пищеварения в анамнезе, а также отсутствие перенесенных острых кишечных инфекций в течение предшествовавших 12 месяцев.
Исследование проведено в период разгара болезни, ранней реконвалесценции, а также в ходе катамнестического наблюдения детей длительностью 12 месяцев и кратностью 1 раз в 3 месяца. Комплексное клинико-лабораторное обследование в острый период заболевания проведено в условиях стационара (ФГБУ ДНКЦИБ ФМБА России, отделение кишечных инфекций), в период катамнестического наблюдения – амбулаторно (медицинский центр ФБУН НИИ ЭИМ им. Пастера).
В процессе катамнестического наблюдения реконвалесцентов ОВКИ учтено появление жалоб на боль в животе, диспепсические явления со стороны верхнего (отрыжка, тошнота и рвота) и нижнего (метеоризм, флатуленция, запоры и диарея) отделов пищеварительного тракта, изменения аппетита, общего самочувствия. Интерпретация результатов наблюдения и постановка диагноза проведены на основании Римских критериев IV пересмотра [15].
При проведении статистического анализа выявленные различные клинические варианты ФГИР в соответствии с подходом, применяемым в международных публикациях, были объединены в одну рубрику. Проведено сопоставление параметров преморбидного фона у детей двух групп: сформировавших ФГИР (ФГИР+; n=30) и не сформировавших таковых (ФГИР-; n=113) после ОВКИ в катамнестическом периоде от 6 до 12 месяцев. При сборе и анализе анамнестических сведений о пациентах большое внимание уделено эпидемиологическим данным, характеризующим условия жизни и воспитания детей; особенностям питания, наследственности и перенесенным заболеваниям. На каждого ребенка заполнялась стандартизованная индивидуальная карта пациента.
В качестве неблагоприятных факторов, способных влиять на исходы ОВКИ, рассматривался широкий спектр показателей, таких как течение беременности и родов у матери, наследственная предрасположенность к заболеваниям органов пищеварения и аллергической патологии, особенности вскармливания ребенка в грудном возрасте, особенности образа жизни.
При оценке течения беременности и родов у матери принято во внимание наличие гестоза, угрозы прерывания беременности, маловодия, различных заболеваний инфекционной этиологии. Анализировали особенности течения родов, выявив сведения о слабости родовой деятельности, преждевременной отслойке плаценты, стремительных родах, гипоксии плода, использовании акушерских пособий в родах. Среди параметров постнатального анамнеза жизни ребенка обращали внимание на задержку психомоторного развития, недостаточные прибавки массы тела на первом году жизни и в последующие периоды, свидетельствовавших о гипотрофии, выявляли данные о раннем переводе детей на искусственное вскармливание. Помимо этого учитывали наличие в анамнезе аллергической патологии, рецидивирующих заболеваний ЛОР-органов (аденоидит, тонзиллит, синусит), частых инфекций респираторной системы (более 3 эпизодов за 6 месяцев), рецидивирующего обструктивного бронхита, повторные курсы антибактериальных препаратов, а также постоянный прием сильнодействующих (гормональных и др.) лекарственных препаратов.
Подробно изучали социальный анамнез; в частности, отмечали наличие неполной семьи, плохие бытовые условия, низкий экономический семейный статус.
Статистическая обработка материала исследования проведена с помощью программы STATISTICA v. 10 (StatSoft Inc., США) с использованием параметрических и непараметрических критериев. Разработка модели прогнозирования развития ФГИР осуществлена с помощью дискриминантного анализа на основании выявления признаков, значимо влияющих на отнесение конкретного больного к одной из классификационных групп.
Результаты
Данные катамнестического наблюдения реконвалесцентов ОВКИ показали, что жалобы гастроэнтерологического характера, типичные для ФГИР, предъявили 82 (57,3%) пациента. Следует отметить, что у 22 (15,4%) наблюдавшихся детей эти жалобы выявлены вскоре после выписки из стационара и длительно сохранялись, несмотря на проведение коррекции диеты и назначение симптоматического амбулаторного лечения в постинфекционном периоде. Наиболее часто (n=22; 15,4%) появление симптомов ФГИР наблюдали в период с 3-го по 6-й месяц катамнестического наблюдения. Отмечена значительная индивидуальная вариабельность и непостоянность симптоматики ФГИР в динамике наблюдения, что наряду с определенными проблемами выявления жалоб у детей частично затрудняло нозологическую диагностику. Кроме того, при повторных амбулаторных осмотрах нередко отмечали появление новых симптомов на фоне полного или частичного регресса предшествовавших.
Ведущими клиническими симптомами ФГИР в период катамнестического наблюдения реконвалесцентов ОВКИ вне зависимости от возраста детей являлись абдоминальные боли (n=49; 34,3%) и запоры (n=33; 23,1%).
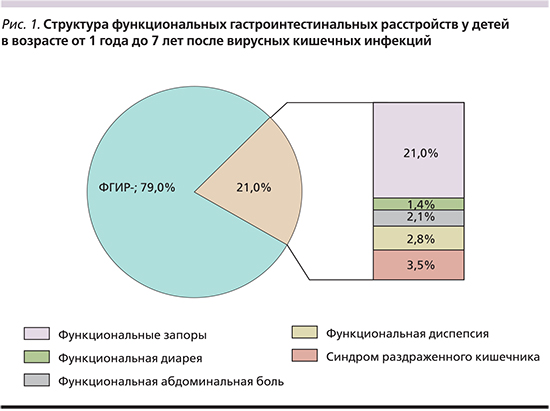
В результате проведенного диспансерного наблюдения детей, перенесших ОВКИ, ФГИР были диагностированы у 30 (21,0%) их них. Структура ФГИР представлена пятью нозологическими формами, которые убывали по частоте в следующем ряду: функциональные запоры (n=16; 53,3%), синдром раздраженного кишечника (n=5; 16,7%), функциональная диспепсия (n=4; 13,3%), функциональные абдоминальные боли, не классифицируемые в другие рубрики (n=3; 10%), функциональная диарея (n=2; 6,7%). В общей выборке (n=143), частота этих вариантов ФГИР составила от 11,2 до 1,4% (рис. 1).
В старшей возрастной группе ФГИР встречались несколько чаще (27,1%), чем в младшей (17,9%, p=0,32). В структуру ФГИР в старшей группе вошли четыре нозологические формы: синдром раздраженного кишечника (n=5; 38,5%), функциональная диспепсия (n=4; 30,8%), функциональная абдоминальная боль (n=3; 23,1%) и функциональные запоры (n=1; 7,7%). В структуру ФГИР в младшей возрастной группе вошли только две нозологические формы: функциональные запоры (n=15; 88,2%) и функциональная диарея (n=2; 11,8%).
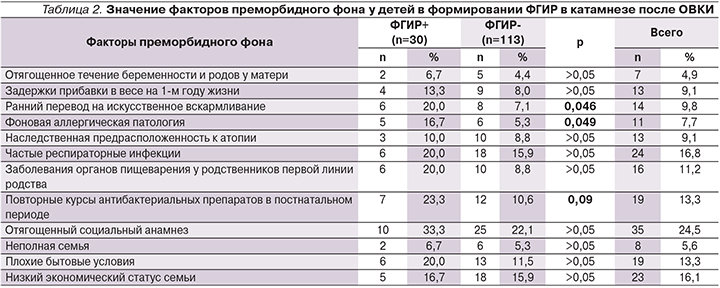
Результаты сопоставления особенностей преморбидного фона у детей в зависимости от исходов в двух группах (сформировавших и не сформировавших ФГИР после ОВКИ) представлены в табл. 2.
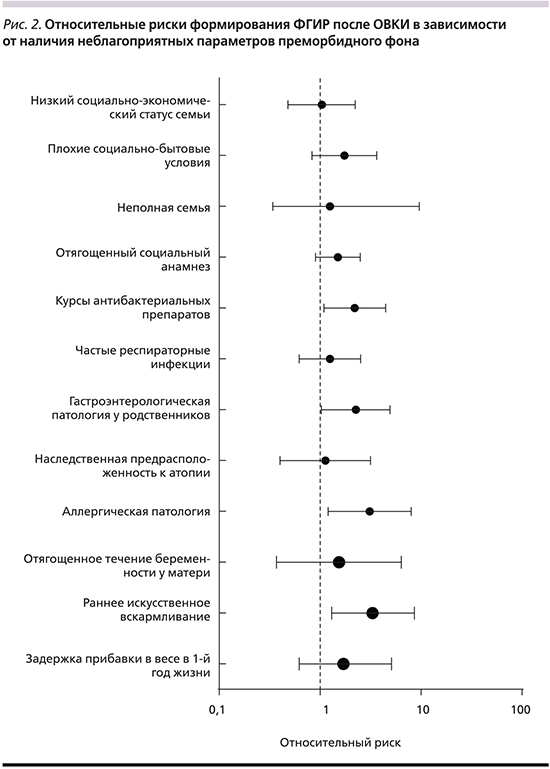
При анализе особенностей течения беременности и родов у матери не было выявлено достоверных различий между сравниваемыми группами (4,4 и 7,1% соответственно). Тем не менее показано, что у детей, матери которых имели неблагоприятные факторы акушерско-гинекологического анамнеза, риск формирования ФГИР увеличивался в 1,5 раза (RR=1,54 [0,37–6,38]).
Большинство детей в сравниваемых группах (92,0 и 86,7% соответственно) имели нормальные прибавки в весе на первом году жизни. В то же время анализ показал, что относительный риск неблагоприятного течения катамнестического периода ОВКИ при наличии задержки прибавок в весе возрастал в 1,7 раза [0,62–5,1]. Значимые отличия в группах были выявлены по частоте раннего перевода детей на искусственное вскармливание. Так, показано, что данный фактор повышает вероятность формирования ФГИР в 3,3 раза [1,2–8,6]. Кроме того, у детей в возрасте 4–7 лет (n=49) риск формирования ФГИР значительно повышался при наличии регулярных погрешностей в питании и нарушениях режима приема пищи (RR=1,8 [0,80–4,07]).
Значимость относительных рисков формирования постинфекционных ФГИР у детей, перенесших ОВКИ, в зависимости от наличия неблагоприятных параметров преморбидного фона представлена на рис. 2.
Наличие хронических заболеваний органов пищеварения у родственников первой линии родства также несколько чаще выявлялось у детей с неблагоприятным течением катамнестического периода (8,8 и 20,0% соответственно; p=0,15). Но данный фактор повышал риск формирования ФГИР в 2 раза (RR=1,98 [1,07–3,65]). Отмечена отчетливая тенденция более частого постинфекционного развития ФГИР у детей с манифестными формами фоновой аллергической патологии (RR=3,1 [1,23–8,1]).
Частые респираторные заболевания и хроническая патология ЛОР-органов с сопоставимой частотой наблюдались в обеих сравниваемых группах (15,9 и 20,0% соответственно). При этом повторные курсы антибактериальных препаратов (основанием для назначения которых были в т.ч. рецидивирующие заболевания ЛОР-органов) ассоциировались с повышенным риском формирования ФГИР (RR=1,7±1,2 и 2,1±1,3 соответственно).
Оцениваемые в исследовании неблагоприятные психосоциальные факторы не имели статистически значимых различий по частоте регистрации в сопоставляемых группах. В то же время имела место тенденция повышения относительного риска формирования ФГИР у детей с выявленными психосоциальными факторами риска. Среди них наибольшую значимость имели плохие бытовые условия (RR=1,74 [0,83–3,64]). Данный фактор тесно связан с особенностями жизни ребенка, в частности питания, режима сна и бодрствования, и отражает взаимосвязь социальных и патофизиологических аспектов в формировании ФГИР.
Стоит, однако, отметить, что ни один из анализируемых факторов не показал достаточной прогностической силы для однозначного утверждения о высоком риске неблагоприятного течения катамнестического периода после ОВКИ.
Для формирования более точного прогноза развития постинфекционных ФГИР с целью их своевременной профилактики был проведен пошаговый дискриминантный анализ, в процессе которого удалось среди множества изолированно изучаемых анамнестических факторов выявить информационно значимое их сочетание, позволяющее с достаточно высокой долей вероятности говорить о возможности формирования ФГИР у детей в течение года после ОВКИ.
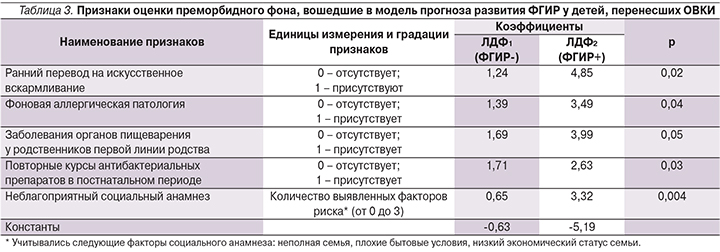
Вошедшие в дискриминантную модель параметры представлены в табл. 3.
Все признаки созданной модели имели достаточный уровень значимости. Данные признаки служат подтверждением важности подробного сбора и анализа анамнестических данных в прогнозировании неблагоприятных исходов ОВКИ.
Прогноз формирования постинфекционных ФГИР у реконвалесцентов ОВКИ определен по следующим формулам:
где значения переменных Х1–Х5 соответствуют числовым значениям выраженности признаков (табл. 3).
По результатам расчета линейных дискриминантных функций определен более вероятный вариант прогноза. При ЛДФ1>ЛДФ2 более вероятным считали отсутствие возможности формирования ФГИР у больных ОВКИ в катамнезе; в случае ЛДФ1
1. Hyams J.S., Di Lorenzo C., Saps M., Shulman R., Staiano A., van Tilburg M. Childhood functional gastrointestinal disorders: child/adolescent. Gastroenterology. 2016;150(6):1456–68.
2. Grad S., Grad C., Baban A., Dumitrascu D. Child abuse in the irritable bowel syndrome. Rom. J. Intern. Med. 2014;52(3):183–88.
3. Бельмер С.В. Функциональные и структурные нарушения органов пищеварения у детей: в поисках границ и критериев. Российский вестник перинатологии и педиатрии. 2013;58(1):4–7.
4. Шадрин О.Г., Платонова Е.М., Гарынычева Т. Новые возможности лечения сочетанных функциональных расстройств желудочно-кишечного тракта у детей. Здоровье ребенка. 2012;5:40.
5. Денисюк Н.Б., Каган Ю.Д. Этиологическая структура и некоторые клинические особенности кишечных инфекций у детей, госпитализированных в инфекционный стационар г. Оренбурга. Медицинский альманах. 2013;30(6):143–46.
6. Ермоленко К.Д., Лобзин Ю.В., Гончар Н.В. Вирусные гастроэнтериты у детей: современные представления об эпидемиологии и профилактике. Журнал инфектологии. 2015;7(3):22–32.
7. Денисюк Н.Б. Современные аспекты лабораторной диагностики и профилактики ротавирусной инфекции у детей. Журнал инфектологии. 2015;7(1):31–8.
8. Горелов А.В., Плоскирева А.А., Дорошина Е.А., Подкользин А.Т., Тхакушинова Н.Х. Норовирусная инфекция на современном этапе: клинические проявления и терапевтические подходы. Инфекционные болезни. 2011;9(2):100–5.
9. Pensabene L., Talarico V., Concolino D., Ciliberto D., Campanozzi A., Gentile T., Rutigliano V., Salvatore S., Staiano A., Di Lorenzo C.; Post-Infectious Functional Gastrointestinal Disorders Study Group of Italian Society for Pediatric Gastroenterology, Hepatology and Nutrition. Postinfectious functional gastrointestinal disorders in children: a multicenter prospective study. J. Рediatr. 2015;166(4):903–7.
10. Ермоленко К.Д., Гончар Н.В., Добренко В.А., Лобзин Ю.В. Снижение качества жизни и развитие постинфекционной функциональной патологии органов пищеварения у детей раннего возраста. Вопросы детской диетологии. 2016; 14(5):6–13.
11. Spiller R., Lam С. An update on post-infectious irritable bowel syndrome: role of genetics, immune activation, serotonin and altered microbiome. J. Neurogastroenterol. Motil. 2012;18(3):258–68.
12. Григорович М.С. Функциональное состояние желудочно-кишечного тракта и особенности исходов при острых кишечных инфекциях. Эпидемиология и инфекционные болезни. 2012;3:56–9.
13. Wouters M.M., Van Wanrooy S., Nguyen A., Dooley J., Aguilera-Lizarraga J., Van Brabant W., Garcia-Perez J.E., Van Oudenhove L., Van Ranst M., Verhaegen J., Liston A., Boeckxstaens G. Psychological comorbidity increases the risk for postinfectious IBS partly by enhanced susceptibility to develop infectious gastroenteritis. Gut. 2016;65(8):1279–88.
14. Cocciolillo S., Collins S.M. The long-term functional consequences of acute infectious diarrhea. Curr. Оpin. Gastroenterol. 2016;32(1):1–6.
15. Drossman D.A. Functional Gastrointestinal Disorders: History, Pathophysiology, Clinical Features and Rome IV. Gastroenterology. 2016;150(6):1262–79.
16. Ермоленко К.Д., Гончар Н.В., Ермоленко Е.И. и др. Нарушение микробиоценоза кишечника как фактор формирования постинфекционной патологии органов пищеварения у детей после вирусных кишечных инфекций. Экспериментальная и клиническая гастроэнтерология. 2017;131(1):53–7.
17. Ahmad O.F., Akbar А. Microbiome, antibiotics and irritable bowel syndrome. Int. Rev. Neurobiol. 2016;131:247–61.
18. Actis G., Pellicano R., Fadda M., Rosina F. Antibiotics and non-steroidal anti-inflammatory drugs in outpatient practice: indications and unwanted effects in a gastroenterological setting. Curr. Drug Saf. 2014;9(2):133–37.