почему реакция нейтрализации так называется
Реакция нейтрализации

Всего получено оценок: 490.
Всего получено оценок: 490.
Взаимодействие кислоты и основания с образованием соли и воды называется реакцией нейтрализации. Обычно подобные реакции протекают с выделением тепла.
Общее описание
Суть нейтрализации состоит в том, что кислота и основание, обмениваясь активными частями, нейтрализуют друг друга. В результате образуется новое вещество (соль) и нейтральная среда (вода).
Простым и наглядным примером реакции нейтрализации является взаимодействие соляной кислоты и гидроксида натрия:
Если опустить лакмусовую бумажку в раствор соляной кислоты и гидроксида натрия, то она окрасится в фиолетовый цвет, т.е. покажет нейтральную реакцию (красный – кислая среда, синий – щелочная среда).
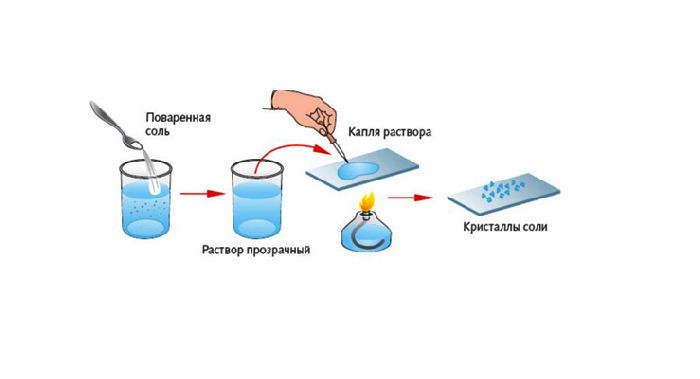
После нагревания получившегося раствора вода испарится, а в пробирке останется поваренная соль – NaCl.
В подобных реакциях вода – обязательный продукт.
Примеры
Реакция нейтрализации может происходить между сильными и слабыми кислотами и щелочами. Рассмотрим два типа реакций:
Примером первого вида реакций является взаимодействие сильной кислоты с сильным основанием:
Обратимые реакции протекают при нейтрализации слабой кислоты сильным основанием, а также слабого основания слабой кислотой:
Слабые нерастворимые или слаборастворимые основания (Fe(OH)3, Fe(OH)2, Mg(OH)2, Zn(OH)2) также нейтрализуются сильной кислотой. Например, гидроокись меди не растворяется в воде, но при взаимодействии с азотной кислотой образует соль (нитрат меди) и воду:
Реакции нейтрализации экзотермичные, они протекают с выделением тепла.
Использование
Реакции нейтрализации – основа титриметрического анализа или титрования. Это метод количественного анализа концентрации веществ. Метод используется в медицине, например, для определения кислотности желудочного сока, а также в фармакологии.

Кроме того, важно практическое применение нейтрализации в лаборатории: при проливе кислоты её можно нейтрализовать щёлочью.
Что мы узнали?
Реакция, при которой кислота и основание образуют соль и воду, называется нейтрализацией. Эта реакция возможна между любыми кислотами и основаниями: сильной кислотой и сильной щёлочью, слабой кислотой и слабым основанием, сильным основанием и слабой кислотой, слабым основанием и сильной кислотой. Реакция протекает с выделением тепла. Нейтрализация применяется в медицине и фармакологии.
Общие принципы
Сущность реакции нейтрализации заключается в том, что кислота и основание вступают во взаимодействие. Они обмениваются активными компонентами. Происходит нейтрализация обоих составляющих. В итоге получается вода и соль, имеющие нейтральную реакцию среды.
Общий принцип взаимодействия выглядит следующим образом: кислота соединяется со щёлочью, обменивается активными компонентами, в результате чего получается нейтральная соль и вода.
Наиболее простым примером реакции нейтрализации может стать взаимодействие гидроксида натрия с соляной кислотой. Формула представлена так:
NaOH + HCl → NaCl + H2O.
Перед соединением этих веществ можно проверить их реакцию с помощью лакмусовой бумаги:
Если получившийся раствор нагреть, вода постепенно испарится. В колбе останется осадок — поваренная соль (хлорид натрия).
Чтобы лучше понять, что такое реакция нейтрализации в химии, важно помнить, что 2 сложных вещества обмениваются между собой частями. В итоге получается 2 новых сложных компонента. Таким образом, нейтрализация — это частный случай большой группы реакций обмена.
Некоторые основания не растворяются в воде, но хорошо растворяются в кислотах. В результате взаимодействия тоже образуется вода и соль. Примером может быть реакция между нерастворимым гидроксидом меди и серной кислотой. В итоге получается медный купорос и вода.
Виды реакции
Процесс химической нейтрализации может происходить между веществами с разной активностью: сильной кислотой и таким же основанием или между слабой кислотой и сильной щёлочью. В химии выделяют 2 типа реакции:
Реакции нейтрализации относятся к разряду экзотермичных. При взаимодействии выделяется много энергии в виде тепла. Количество выделенной энергии — относительный показатель, который получил название теплового эффекта химической реакции.
Мера энергии, накопленной веществом при образовании, называется энтальпией. В экзотермических реакциях значение энтальпии всегда бывает отрицательным.
Названия солей
Все международные химические названия солей, полученных в результате нейтрализации, строятся по единому принципу и состоят из двух слов. Первое слово — это наименование кислотного остатка. Оно является производным от латинского названия кислоты:
Второе слово в названии соли — это наименование металла. У некоторых элементов периодической таблицы валентность изменяется. В этом случае она указывается в скобках.
В качестве примера можно привести названия солей:
Это утверждение верно и для обратной ситуации — по названию соли можно определить её химическую формулу. Вначале записывается символ, которым металл обозначается в периодической таблице. Затем добавляется формула кислотного остатка.
Следующий шаг — определение валентности обеих частей. Теперь нужно найти для них наименьшее общее кратное и разделить его на валентность каждой части соли. Значит, в результате получается количество атомов металла в формуле и количество кислотных остатков.
Кислотный остаток может иметь сложную структуру и содержать в себе несколько разных атомов (азотная, серная, фосфорная кислоты и пр.). При составлении формулы соли кислотный остаток вписывается в скобки. За ними цифровым индексом обозначается количество остатков.
Титрование и химический эквивалент
Реакция нейтрализации связана с процедурой титрования. В химии так принято называть определение количества щёлочи или кислоты в растворе. Для этого берётся реагент с заданной заранее молярной концентрацией. Вычисляется, сколько его нужно для осаждения искомого вещества. При титровании используется понятие химической эквивалентности:
Если реагируют одинаковые химические эквиваленты, нейтрализация называется полной. В этом случае в растворе не останется кислоты или щёлочи, не вступившей в реакцию. Масса эквивалента кислоты или основания в граммах называется грамм-эквивалентом.
Все кислоты, которые выделяют из 1 молекулы 1 ион водорода, подчиняются следующей закономерности: их химический эквивалент равняется 1 молю вещества. Молекулярная масса таких соединений равна 1 грамм-эквиваленту.
Если вещество выделяет из 1 молекулы 2 иона водорода, его грамм-эквивалент равен половине молекулярной массы, а 1 моль соответствует 2 химическим эквивалентам.
С этим химическим процессом связано ещё одно понятие — нормальность или нормальная концентрация вещества. Этот фактор отражает, сколько эквивалентов содержит 1 литр раствора.
Применение на практике
Методы нейтрализации положены в основу титриметрического анализа. Титрование используется во многих сферах:
Нередко эта химическая реакция используется в быту. При проливе уксусной или другой кислоты на кожу может возникнуть ожог. В качестве первой помощи необходимо тщательно промыть место чистой водой, после чего обработать содовым раствором. Той же тактики придерживаются при ожоге едкой щёлочью. В качестве нейтрализатора используется лимонная или уксусная кислота в слабом разведении.
Реакция нейтрализации – примеры, типы и применение
Взаимодействие кислоты и основания с образованием соли и воды называется реакцией нейтрализации. Обычно подобные реакции протекают с выделением тепла.
Общее описание
Суть нейтрализации состоит в том, что кислота и основание, обмениваясь активными частями, нейтрализуют друг друга. В результате образуется новое вещество (соль) и нейтральная среда (вода).
Простым и наглядным примером реакции нейтрализации является взаимодействие соляной кислоты и гидроксида натрия:
HCl + NaOH → NaCl + H2O.
Если опустить лакмусовую бумажку в раствор соляной кислоты и гидроксида натрия, то она окрасится в фиолетовый цвет, т.е. покажет нейтральную реакцию (красный – кислая среда, синий – щелочная среда).
Раствор двух активных соединений превратился в воду за счёт обмена натрием и хлором, поэтому ионное уравнение данной реакции выглядит следующим образом:
После нагревания получившегося раствора вода испарится, а в пробирке останется поваренная соль – NaCl.
Рис. 1. Образование соли после выпаривания.
В подобных реакциях вода – обязательный продукт.
Примеры
Реакция нейтрализации может происходить между сильными и слабыми кислотами и щелочами. Рассмотрим два типа реакций:
Примером первого вида реакций является взаимодействие сильной кислоты с сильным основанием:
Обратимые реакции протекают при нейтрализации слабой кислоты сильным основанием, а также слабого основания слабой кислотой:
Слабые нерастворимые или слаборастворимые основания (Fe(OH)3, Fe(OH)2, Mg(OH)2, Zn(OH)2) также нейтрализуются сильной кислотой. Например, гидроокись меди не растворяется в воде, но при взаимодействии с азотной кислотой образует соль (нитрат меди) и воду:
Cu(OH)2 + 2HNO3 ↔ Cu(NO3)2 + 2H2O.
Рис. 2. Взаимодействие гидроокиси меди с кислотой.
Реакции нейтрализации экзотермичные, они протекают с выделением тепла.
Использование
Реакции нейтрализации – основа титриметрического анализа или титрования. Это метод количественного анализа концентрации веществ. Метод используется в медицине, например, для определения кислотности желудочного сока, а также в фармакологии.
Кроме того, важно практическое применение нейтрализации в лаборатории: при проливе кислоты её можно нейтрализовать щёлочью.
Что мы узнали?
Реакция, при которой кислота и основание образуют соль и воду, называется нейтрализацией. Эта реакция возможна между любыми кислотами и основаниями: сильной кислотой и сильной щёлочью, слабой кислотой и слабым основанием, сильным основанием и слабой кислотой, слабым основанием и сильной кислотой. Реакция протекает с выделением тепла. Нейтрализация применяется в медицине и фармакологии.
Реакция нейтрализации
Разделы: Химия
(Урок сопровождается презентацией)
Составляем уравнение реакции и поясняем, почему она называется реакцией нейтрализации (образование соли и воды), почему её сле-дует рассматривать как частный случай реакции обмена.
Прибываем на станцию «Лабораторная».
(слайд 5)
1 группа. Гидроксид меди(II) с растворами кислот(соляной, серной, азотной).
2 группа. Гидроксид железа(III) с растворами кислот(соляной, серной, азотной).
Затем учащиеся составляют уравнения реакций, совместно проверяют и делают общий вывод.
(слайд 7)
2.В чём заключается сущность этой реакции?
1. Какие реакции относятся к реакциям нейтрализации?
2. Какую мерную посуду используют для проведения демонстрационного опыта «реакции нейтрализации»?
3. Какую окраску лакмус приобретет в кислой среде?
4. Укажите порядок действий при проведении реакции нейтрализации.
Б) по каплям приливать раствор щелочи;
В) выпаривать раствор;
5. Что необходимо сделать при случайном попадании раствора кислоты на кожу руки?
А) промыть большим объёмом воды;
Б) вытереть салфеткой;
В) пойти в медпункт;
Г) промыть 2%-м раствором питьевой соды.
Учёт знаний, умений и навыков во время лабораторного опыта
Специфика протекания процесса химической нейтрализации
Нейтрализация – химическая реакция, происходящая между двумя составами, имеющими свойства кислоты и основания. В результате их взаимодействия происходит потеря свойств обоих веществ, что приводит к выделению соли и воды.
Сфера применения нейтрализации
Вычисления по этой реакции особенно часто используются:
Метод нейтрализации применяется в клинических лабораториях для определения буферной емкости плазмы крови, кислотности желудочного сока. Активно используется и в фармакологии, когда нужно провести количественный анализ неорганических и органических кислот. Проводить этот процесс можно по всем правильно составленным уравнениям.
Внешние проявления нейтрализации
Процесс нейтрализации кислоты можно наблюдать, если вначале к раствору добавить несколько капель индикатора, который позволит изменить окраску раствора. Когда к этой смеси добавляется щелочь, то окраска полностью исчезает. Но стоит учитывать, что индикаторы меняют свою окраску не строго в эквивалентной точке, а с отклонением. Поэтому даже при правильном выборе индикатора допускается погрешность. Если же он был выбран неправильно, то все результаты оказываются искаженными.
В условиях школьной программы для этого применяют лимонную кислоту и нашатырный спирт. В качестве примера можно рассмотреть процесс реакции между соляной кислотой и едким натром. В результате их взаимодействия образовывается известный всем раствор пищевой соли в воде. Также в качестве индикаторов могут выступать:
Необходимо отметить, что реакция, обратная нейтрализации, называется гидролизом. Его результатом является образование слабой кислоты или основания.
При выборе нейтрализующего вещества обязательно учитываются:
Раньше в качестве нейтрализатора применяли окись магния. Сейчас она не пользуется популярностью, поскольку имеет высокую стоимость и вступает в реакцию достаточно медленно.
Виды реакции нейтрализации
В процессе взаимодействия сильного основания такой же сильной кислотой происходит смещение реакции в сторону образования воды. Вместе с тем этот процесс не доходит до конца, поскольку начинается гидролиз соли.
При нейтрализации слабой кислоты сильным основанием можно говорить об обратимой реакции. Как правило, в таких системах протекание реакции смещается в сторону образования соли, поскольку вода является более слабым электролитом, чем, например, синильная, уксусная кислота или аммиак.
Скорость процесса нейтрализации изменяется в зависимости от специфики используемых веществ. Например, при применении NaOH необходимая степень кислотности появляется практически сразу же. СаО приводит к возникновению нужной реакции только через 15-20 минут, а MgO – через 45 минут. При этом в последних двух случаях наиболее сильное понижение кислотности наблюдается в первые 5 минут после того как было внесено нейтрализующее вещество. Если скорость процесса не очень высокая, то еще больше его начинает тормозить вторичное окисление.
Выделение тепла в процессе нейтрализации
Часто это происходит под воздействием азотной кислоты. Чем выше ее количество, тем больше выделяется тепла. При получении поваренной соли воздействие тепла приводит к нежелательным последствиям, поскольку она начинает разлагаться с выделением хлора. Из-за выделения тепла можно говорить о том, что все реакции нейтрализации являются экзотермическими. Его выделение происходит из-за возникновения разницы между суммарной энергией ионов Н+ и ОН-, а также энергией образования молекул воды.