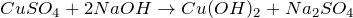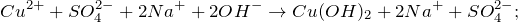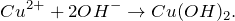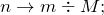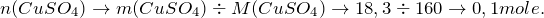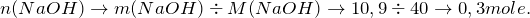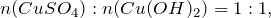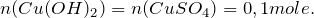Cuso4 naoh что наблюдается
Cuso4 naoh что наблюдается
Осуществите следующие превращения:
Cu 

Растворить металлическую медь с образованием сульфата меди (II) можно в концентрированной серной кислоте. Уравнение реакции:
Реакция протекает при обычных условиях, будет наблюдаться растворение меди и образование раствора голубого цвета.
Получить гидроксид меди (II) из сульфата меди (II) возможно при приливании раствора щелочи – гидроксида натрия. Уравнение реакции:
Реакция протекает при обычных условиях, будет наблюдаться выпадение осадка ярко-голубого цвета.
Необходимые реактивы: металлическая медь Cu, концентрированный раствор серной кислоты H2SO4, раствор гидроксида натрия NaOH.
Необходимая посуда и оборудование: пробирки, штатив для пробирок.
Выполнение работы: в пробирку поместили кусочек меди и прилили концентрированный раствор серной кислоты, происходит растворение меди, выделение бесцветного газа с характерным запахом (оксида серы (IV)) и образование раствора голубого цвета – сульфата меди (II).
К полученному раствору сульфата меди (II) прилили раствор гидроксида натрия, наблюдается выпадение осадка ярко-голубого цвета – гидроксида меди (II).
Вывод: в результате выполнения работы получили раствор сульфата меди (II) и нерастворимый гидроксид меди (II).
Запишем ионное уравнение, однако, следует учесть, что гидроксид меди (II) нерастворимое в воде соединение, т.е. в водном растворе не распадается на ионы.
Первое уравнение называют полным ионным, а второе – сокращенным ионным.
Теперь переходим к решению задачи. Первоначально рассчитаем количество молей веществ, вступивших в реакцию (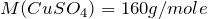
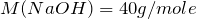
Это означает, что гидроксид натрия находится в избытке и дальнейшие расчеты производим по сульфату меди (II).
Согласно уравнению реакции
Тогда масса гидроксида меди (II) будет равна (молярная масса – 98 g/mole):