Cuoh 2co3 что это
Дигидроксокарбонат меди(II)
| Дигидроксокарбонат меди(II) | |
| Общие | |
|---|---|
| Систематическое наименование | Дигидроксокарбонат меди(II) |
| Традиционные названия | Дигидроксид-карбонат димеди |
| Химическая формула | Cu2(OH)2CO3 |
| Физические свойства | |
| Состояние (ст. усл.) | тёмно-зелённые кристаллы |
| Молярная масса | 221,11 г/моль |
| Плотность | 4,05 г/см³ |
| Термические свойства | |
| Температура плавления | разл. 200 °C |
Дигидроксокарбонат меди(II) — неорганическое соединение, основная соль металла меди и угольной кислоты с формулой (CuOH)2CO3, тёмно-зелёные кристаллы, не растворимые в воде.
Содержание
Получение
Физические свойства
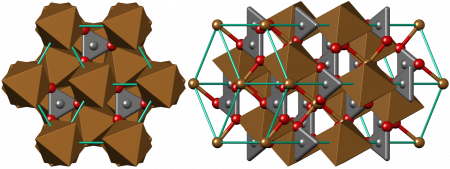
Дигидроксокарбонат меди(II) образует тёмно-зелённые кристаллы моноклинной сингонии, пространственная группа P 21/a, параметры ячейки a = 0,9502 нм, b = 1,1974 нм, c = 0,3240 нм, β = 98,75°, Z = 4.
Не растворим в воде, р ПР = 33,11.
Химические свойства
Литература
Полезное
Смотреть что такое «Дигидроксокарбонат меди(II)» в других словарях:
Оксид меди(I) — Оксид меди(I) … Википедия
Оксид меди(II) — Оксид меди(II) … Википедия
Гидроксид меди(II) — У этого термина существуют и другие значения, см. Гидроксид меди. Гидроксид меди(II) … Википедия
Сульфат меди(II) — У этого термина существуют и другие значения, см. Сульфат меди. Сульфат меди(II) … Википедия
Хлорид меди(II) — У этого термина существуют и другие значения, см. Хлорид меди. Хлорид меди(II) … Википедия
Фторид меди(II) — Фторид меди(II) … Википедия
Иодид меди(I) — Иодид меди(I) … Википедия
Карбонат меди(II) — Общие … Википедия
Нитрат меди(II) — Нитрат меди(II) … Википедия
Сульфид меди(I) — Кристалличесая структура халькозина … Википедия
Оксид меди (II)
Оксид меди (II)
Оксид меди (II) CuO – твердое кристаллическое вещество черного цвета.
Способы получения оксида меди (II)
Оксид меди (II) можно получить различными методами :
1. Термическим разложением гидроксида меди (II) при 200°С :
2. В лаборатории оксид меди (II) получают окислением меди при нагревании на воздухе при 400–500°С:
2Cu + O2 → 2CuO
3. В лаборатории оксид меди (II) также получают прокаливанием солей (CuOH)2CO3, Cu(NO3)2:
Химические свойства оксида меди (II)
1. При взаимодействии оксида меди (II) с сильными и растворимыми кислотами образуются соли.
СuO + 2HBr = CuBr2 + H2O
CuO + 2HCl = CuCl2 + H2O
2. Оксид меди (II) вступает в реакцию с кислотными оксидами.
3. Оксид меди (II) не взаимодействует с водой.
4. В окислительно-восстановительных реакциях соединения меди (II) проявляют окислительные свойства:
3CuO + 2NH3 → 3Cu + N2 + 3H2O
Оксид меди (II) можно восстановить углеродом, водородом или угарным газом при нагревании:
СuO + C → Cu + CO
Более активные металлы вытесняют медь из оксида.
3CuO + 2Al = 3Cu + Al2O3
Карбонат меди (II)
| Карбонат меди (II) | |
|---|---|
 | |
| Систематическое наименование | Карбонат меди (II) |
| Традиционные названия | Углекислая медь |
| Хим. формула | CuCO3 |
| Состояние | твёрдое |
| Молярная масса | 123,555 г/моль |
| Плотность | 3,9 г/см³ |
| Температура | |
| • разложения | 290 °C |
| Растворимость | |
| • в воде | вещество нерастворимо в воде |
| ГОСТ | ГОСТ 8927-79 |
| Рег. номер CAS | 1184-64-1 |
| PubChem | 14452 |
| Рег. номер EINECS | 214-671-4 |
| SMILES | |
| ChemSpider | 13799 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Карбонат меди (II) — CuCO3, соль меди и угольной кислоты, внешняя составная часть патины.
Содержание
Физические свойства
Карбонат меди (II) — белое кристаллическое вещество со слабым зеленоватым оттенком (вследствие гидролиза), почти нерастворим в воде.
Получение
Непосредственно обменными реакциями в водных растворах между солями Cu (II) и растворимыми карбонатами других металлов карбонат меди получить нельзя. Вследствие сильного гидролиза выделяются гидроксокарбонаты (основные карбонаты) составов: CuCO3·Cu(OH)2 и 2CuCO3·Cu(OH)2, в зависимости от температуры и концентраций реагентов:
Средний карбонат меди СuCO3 получают обработкой основных карбонатов углекислым газом под давлением 4,6 МПа при 180 °C:
Химические свойства
Карбонат меди (II) неустойчив и при нагревании разлагается:
Как и все карбонаты легко реагируют с кислотами с образованием соответствующих солей меди (II) и выделением диоксида углерода:
Водный раствор аммиака и цианидов металлов растворяют карбонат меди с образованием аммиакатов или цианокомплексов Cu (II):
Применение
Нормальный карбонат меди не нашёл какого-либо заметного применения, однако получили широкое применение более доступные и дешёвые гидроксокарбонаты меди. Их используют для получения других соединений меди; плотный малахит — ценный поделочный камень, землистый малахит и мелкие скопления чистого минерала используют для изготовления краски «малахитовая зелень», а также для получения меди (в случае окисленных и смешанных руд). Азурит применяют для получения меди, как компонент пиротехнических составов, изготовления синей краски.
Карбонат меди(II)
| Карбонат меди(II) | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | Kарбонат меди(II) |
| Традиционные названия | Углекислая медь |
| Химическая формула | CuCO3 |
| Физические свойства | |
| Состояние (ст. усл.) | твёрдое |
| Молярная масса | 123,555 г/моль |
| Плотность | 3,9 г/см³ |
| Термические свойства | |
| Температура разложения | 290 °C |
| Химические свойства | |
| Растворимость в воде | вещество нерастворимо в воде |
Содержание
Физические свойства
Карбонат меди(II) — белое кристаллическое вещество, с слабым зеленоватым оттенком (вследствие гидролиза).
Получение
Непосредственно обменными реакциями в водных растворах между солями Cu(II) и растворимыми карбонатами других металлов карбонат меди получить нельзя. Вследствие сильного гидролиза выделяются гидроксокарбонаты (основные карбонаты) составов: CuCO3·Cu(OH)2 и 2CuCO3·Cu(OH)2, в зависимости от температуры и концентраций реагентов:
Нормальный карбонат меди СuСО3 получают обработкой основных карбонатов углекислым газом под давлением 4,6 МПа при 180 °C:
Химические свойства
Карбонат меди(II) неустойчив и при нагревании разлагается:
Как и все карбонаты легко реагируют с кислотами с образованием соответствующих солей меди(II) и выделением диоксида углерода:
Водный раствор аммиака и цианидов металлов растворяют карбонат меди с образованием аммиакатов или цианокомплексов Cu(II):

Применение
Нормальный карбонат меди не нашёл какого-либо заметного применения, однако получили широкое применение более доступные и дешёвые гидроксокарбонаты меди. Их используют для получения других соединений меди; плотный малахит — ценный поделочный камень, землистый малахит и мелкие скопления чистого минерала используют для изготовления краски «малахитовая зелень», а также для получения меди (в случае окисленных и смешанных руд). Азурит применяют для получения меди, как компонент пиротехнических составов, изготовления синей краски.
См. также
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Hg2 2+ | Pb 2+ | Sn 2+ | Cu + | Cu 2+ | |
| OH − | P | P | P | — | P | М | Н | М | Н | Н | Н | — | Н | Н | Н | Н | Н | — | — | Н | Н | Н | Н | |
| F − | P | Н | P | P | Р | М | Н | Н | М | Р | Н | Н | Н | Р | Р | М | Р | Р | М | М | Н | Р | Н | Р |
| Cl − | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | Н | М | — | Н | Р |
| Br − | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | Н | М | Р | H | Р |
| I − | P | P | P | P | Р | Р | Р | Р | Р | Р | ? | Р | — | Р | Р | Р | Р | Н | Н | Н | Н | М | Н | — |
| S 2− | P | P | P | P | — | Р | М | Н | Р | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| SO3 2− | P | P | P | P | Р | М | М | М | Н | ? | ? | М | ? | Н | Н | Н | М | Н | Н | Н | Н | ? | Н | ? |
| SO4 2− | P | P | P | P | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Н | Р | Р | Р |
| NO3 − | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | — | Р | Р |
| NO2 − | P | P | P | P | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? | ? | ? |
| PO4 3− | P | Н | P | P | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | ? | Н | Н | Н | Н |
| CO3 2− | М | Р | P | P | Р | Н | Н | Н | Н | — | — | Н | — | Н | Н | — | Н | Н | — | Н | — | — | ? | — |
| CH3COO − | P | Р | P | P | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | М | Р | — | Р | Р |
| CN − | P | Р | P | P | Р | Р | Р | Р | Р | ? | Н | Н | — | Н | Н | Н | Н | Н | Р | Н | Р | — | — | Н |
| SiO3 2− | H | Н | P | P | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | ? | Н | ? | ? | ? |
Полезное
Смотреть что такое «Карбонат меди(II)» в других словарях:
основный карбонат меди(II) — основная углекислая медь(II) … Cловарь химических синонимов I
МЕДИ КАРБОНАТ ОСНОВНОЙ — Cupri subcarbonas. Cuprum subcarbonicum. Синонимы: углекислая медь, основная углекислая медь, малахит. Свойства. Мелкий, пылевидный порошок светло зеленого цвета, без запаха и вкуса, нерастворимый в воде, разлагается при температуре 200°С. Качес … Отечественные ветеринарные препараты
Карбонат марганца(II) — Карбонат марганца(II) … Википедия
Карбонат иттрия — Общие Систематическое наименование Карбонат иттрия Традиционные названия Углекислый иттрий Химическая формула Y2(CO3)3 Физические свойства … Википедия
МЕДИ КАРБОНАТ — CuCO3. Из водных растворов кристаллизуются основные карбонаты: CuCO3. Cu(OH)2 (минерал малахит) темно зеленые кристаллы; 2CuCO3. Cu(OH)2 (минерал азурит) синие кристаллы … Большой Энциклопедический словарь
меди карбонат — CuCO3. Из водных растворов кристаллизуются основные карбонаты: CuCO3·Cu(ОН)2 (минерал малахит) тёмно зелёные кристаллы; 2CuCO3·Cu(ОН)2 (минерал азурит) синие кристаллы. * * * МЕДИ КАРБОНАТ МЕДИ КАРБОНАТ, CuCO3. Из водных растворов… … Энциклопедический словарь
Меди карбонаты — углекислые соли меди. Средний (нормальный) М. к. не получен. В природе встречаются минералы изумрудно зелёный Малахит состава CuCO3․Cu(OH)2 и небесно голубой Азурит 2CuCO3․Cu(OH)2. Действием Na2CO3 на CuSO4 в водном растворе получают… … Большая советская энциклопедия
МЕДИ КАРБОНАТ — СuСО3. Из водных р ров кристаллизуются основные карбонаты: СuСО3*Сu(ОН)3 (минерал малахит) тёмно зелёные кристаллы; 2СuСО3*Сu(ОН)2 (минерал азурит) синие кристаллы … Естествознание. Энциклопедический словарь
МЕДИ КАРБОНАТ — основной (Cupri subcarbonas), антгельминтик. Пылевидный порошок светло зелёного цвета без запаха, нерастворим в воде. Применяют при мониезиозе овец. С лечебной целью М. к. дают в смеси с дроблёным зерном в течение 2 сут в дозе (на 1 сут): ягнёнку … Ветеринарный энциклопедический словарь
Хром, железо и медь
Твердый металл голубовато-белого цвета. Этимология слова «хром» берет начало от греч. χρῶμα — цвет, что связано с большим разнообразием цветов соединений хрома. Массовая доля этого элемента в земной коре составляет 0.02% по массе.
В промышленности хром получают прокаливанием хромистого железняка с углеродом. Также применяют алюминотермию для вытеснения хрома из его оксида.
Протекает в раскаленном состоянии.
С холодными концентрированными серной и азотной кислотой реакция не идет. Она начинается только при нагревании.
Хром способен вытеснить из солей металлы, стоящие в ряду напряжений правее него.
Соединения хрома (II)
Гидроксид хрома (II), как нерастворимый гидроксид, легко разлагается при нагревании на соответствующий оксид и воду, реагирует с кислотами, кислотными оксидами.
Соединения хрома (III)
Это наиболее устойчивые соединения, которые носят амфотерный характер. К ним относятся оксид хрома (III) гидроксид хрома (III).
H2O + NaOH + Cr2O3 → Na3[Cr(OH)6] (в растворе, гексагидроксохромат натрия)
Cr2O3 + 2NaOH → (t°) 2NaCrO2 + H2O (прокаливание, хромит натрия)
Cr2O3 + HCl = CrCl3 + H2O (сохраняем степень окисления Cr +3 )
Оксид хрома (III) реагирует с более активными металлами (например, при алюминотермии).
При окислении соединение хрома (III) получают соединения хрома (VI) (в щелочной среде).
Соединения хрома (VI)
Хроматы переходят в дихроматы с увеличением кислотности среды (часто в реакциях с кислотами). Цвет раствора меняется с желтого на оранжевый.
Разложение дихромата аммония выглядит очень эффектно и носит название «вулканчик» 🙂
В степени окисления +6 соединения хрома проявляют выраженные окислительные свойства.
Железо
Является одним из самых распространенных элементов в земной коре (после алюминия), составляет 4,65% ее массы.
Для железа характерны две основные степени окисления +2, +3, +6.
Основными сплавами железа являются чугун и сталь. В стали содержание углерода менее 2%, меньше содержится P, Mn, Si, S. Чугун отличается бо́льшим содержанием углерода (2-6%), содержит больше P, Mn, Si, S.
Fe + S = FeS (t > 700°C)
Качественной реакцией на ионы Fe 2+ также является взаимодействие с щелочью (гидроксидом натрия). В результате выпадает осадок зеленого цвета.
Соединения железа (III) проявляют амфотерные свойства. Оксид и гидроксид железа (III) реагирует и с кислотами, и с щелочами.
Fe(OH)3 + KOH = K3[Fe(OH)6] (гексагидроксоферрат калия)
При сплавлении комплексные соли не образуются из-за испарения воды.
Качественной реакцией на ионы Fe 3+ является взаимодействие с желтой кровяной солью K4[Fe(CN)6]. В результате реакции образуется берлинская лазурь (прусский синий).
Реакция хлорида железа (III) с роданидом калия также является качественной, в результате нее образуется характерный раствор ярко красного цвета.
Ферраты можно получить в ходе электролизом щелочи на железном аноде, а также действием хлора на взвесь Fe(OH)3 в щелочи.
Один из первых металлов, освоенных человеком вследствие низкой температуры плавления и доступности получения руды.
Основные степени окисления меди +1, +2.
Пирометаллургический метод получения основан на получении меди путем обжига халькопирита, который идет в несколько этапов.
Медь, как малоактивный металл, выделяется при электролизе солей в водном растворе на катоде.
Во влажном воздухе окисляется с образованием основного карбоната меди.
При нагревании реагирует с кислородом, селеном, серой, при комнатной температуре с: хлором, бромом и йодом.
4Cu + O2 = (t) 2Cu2O (при недостатке кислорода)
2Cu + O2 = (t) 2CuO (в избытке кислорода)
Медь способна восстанавливать неметаллы из их оксидов.
Соединения меди I
В степени окисления +1 медь проявляет основные свойства. Соединения меди (I) можно получить путем восстановления соединений меди (II).
Оксид меди (I) можно восстановить до меди различными восстановителями: угарным газом, алюминием (алюминотермией), водородом.
Оксид меди (I) окисляется кислородом до оксида меди (II).
Оксид меди (I) вступает в реакции с кислотами.
Гидроксид меди CuOH неустойчив и быстро разлагается на соответствующий оксид и воду.
Соединения меди (II)
Степень окисления +2 является наиболее стабильной для меди. В этой степени окисления у меди есть оксид CuO и гидроксид Cu(OH)2. Данные соединения проявляют преимущественно основные свойства.
Оксид меди (II) получают в реакциях термического разложения гидроксида меди (II), реакцией избытка кислорода с медью при нагревании.
При нагревании гидроксид меди (II), как нерастворимое основание, легко разлагается на соответствующий оксид и воду.
Как сказано выше, гидроксид меди (II) носит преимущественно основный характер, однако способен проявлять и амфотерные свойства. В растворе концентрированной щелочи он растворяется, образуя гидроксокомлпекс.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.