Четвертичная структура белка образована за счет чего
Параграф 59. Четвертичная структура белков
Автор текста – Анисимова Елена Сергеевна.
Авторские права защищены. Продавать текст нельзя.
Курсив не зубрить.
Замечания можно присылать по почте: exam_bch@mail.ru
https://vk.com/bch_5
Параграф учебника по биохимии 59:
«ЧЕТВЕРТИЧНАЯ СТРУКТУРА БЕЛКОВ».
(См. сначала п.57 и 58, затем п.6)
Содержание параграфа 59:
59. 1. Четвертичная структура белков.
Глобулы (см. п.58) и фибриллы, имеющие третичную структуру,
могут соединяться (нековалентно обычно),
образуя комплексы.
Это и есть четвертичная структура белка.
Определение:
Четвертичная структура белка –
это соединение (комплекс)
из нескольких отдельных полипептидных цепей (ППЦ),
у каждой из которых обычно есть третичная структура.
Кратко: четвертичная структура – это комплекс глобул. Или нитей-фибрилл.
Термины:
При наличии у белка четвертичной структуры
(а она не у всех белков есть, характерна для регулируемых белков)
отдельную ППЦ (глобулу, например) называют СУБЪЕДИНИЦЕЙ
или протомером, или мономером
(но не путайте эти мономеры
с мономерами типа аминокислот в ППЦ или глюкозы в гликогене).
Комплекс субъединиц называют ОЛИГОМЕРОМ
(олиго- означает несколько).
Олигомеры из двух субъединиц называют димерами,
из четырёх – ТЕТРАМЕРАМИ,
из шести – гексамерами,
из восьми – октамерами.
Пример октамера – октамер гистонов,
на который «наматывается» дуплекс ДНК – п.73 и 74.
Примеры тетрамеров –
гемоглобин и протеинкиназа А
(в ассоциированном виде – п.6).
59. 2. Связи в четвертичной структуре.
Какие связи удерживают субъединицы в комплексе
и тем самым стабилизируют четвертичную структуру (олигомер)? –
Те же самые, что и третичную,
кроме дисудьфидных –
ковалентные связи не характерны для четвертичной структуры,
поскольку важно, чтобы субъединицы могли соединяться и разъединяться.
Те же самые – то есть ионные, водородные и т.д.
59. 2. Положительная и отрицательная кооперативность в олигомерах.
Субъединицы могут влиять на конформацию других субъединиц олигомеров
и за счёт этого –
менять активность субъединиц –
активировать или инактивировать их.
Это влияние одних субъединиц на активность других субъединиц олигомера
называется КООПЕРАТИВНОСТЬЮ.
Активация субъединицы другой субъединицей (при связывании с ней)
называется ПОЛОЖИТЕЛЬНОЙ кооперативностью,
а инактивация субъединицы другой субъединицей
называется ОТРИЦАТЕЛЬНОЙ кооперативностью.
Примеры. –
59. 2. 1. Пример положительной кооперативности.
Молекула гемоглобина состоит из четырёх субъединиц,
то является тетрамером.
Субъединицы гемоглобина активируют друг друга
(то есть в тетрамере гемоглобина наблюдается положительная кооперативность)
– благодаря этому активность тетрамера в 400 раз выше,
чем активность отдельной субъединицы
или чем активность молекулы миоглобина, у которой есть только одна субъединица.
(Миоглобин – это белок мышц.
Он тоже связывает кислород, как и гемоглобин,
но глобулы миоглобина не образуют олигомеры).
Есть группа ферментов, которые катализируют фосфорилирование белков
и называются протеинкиназами.
Одна из них называется протеинкиназой А (ПК А).
Молекула протеинкиназы А (см. п.6 и 95) тоже является тетрамером,
то есть состоит из четырёх субъединиц, как и гемоглобин.
Две субъединицы ПК А
способны катализировать реакцию
(фосфорилировать белки)
и поэтому называются КАТАЛИТИЧЕСКИМИ.
А две другие субъединицы протеинкиназы А
не катализируют реакции,
их функция – регулировать активность каталитических,
поэтому они эти субъединицы называются РЕГУЛЯТОРНЫМИ.
Когда регуляторные субъединицы связаны с каталитическими,
то каталитические не могут работать –
так как регуляторные их инактивируют
(то есть регуляторные являются ингибиторами каталитических),
поэтому тетрамер протеинкиназы не активен.
Кооперативность в протеинкиназе А отрицательная.
Каталитические субъединицы могут работать только тогда,
когда регуляторные отсоединяются от них.
Отсоединение регуляторных от каталитических
(и в итоге активация протеинкиназы А)
происходит тогда,
когда с регуляторными субъединицами связывается цАМФ.
Поэтому цАМФ считается активатором протеинкиназы А.
Таким образом, при положительной кооперативности олигомеры активнее субъединиц,
а при отрицательной кооперативности олигомеры не активны.
59. 3. Олигомерные белки
и полибелковые комплексы (полиферментные комплексы).
Олигомерные белки – это белки, которые образуют олигомеры.
О них выше.
Некоторые белки образуют комплексы из множества ППЦ (обычно глобул).
Это и есть полибелковые комплексы.
Если это комплекс ферментов, то он называется полиферментным комплексом.
Пример такого комплекса – пируват/дегидрогеназный комплекс (ПДГ),
катализирующий превращение пирувата в ацетилКоА (п.32, 20).
В этом комплексе объединены ферменты,
которые катализируют последовательность реакций.
Что даёт объединение белков в комплекс? – повышение эффективности работы.
Глобулы отдельных ферментов передают друг другу метаболиты, работая как конвейер.
Четвертичная структура белка: ее характеристика, особенности и функционирование, специфика олигомерных белков
Четвертичная структура белка
Особенности четвертичной структуры
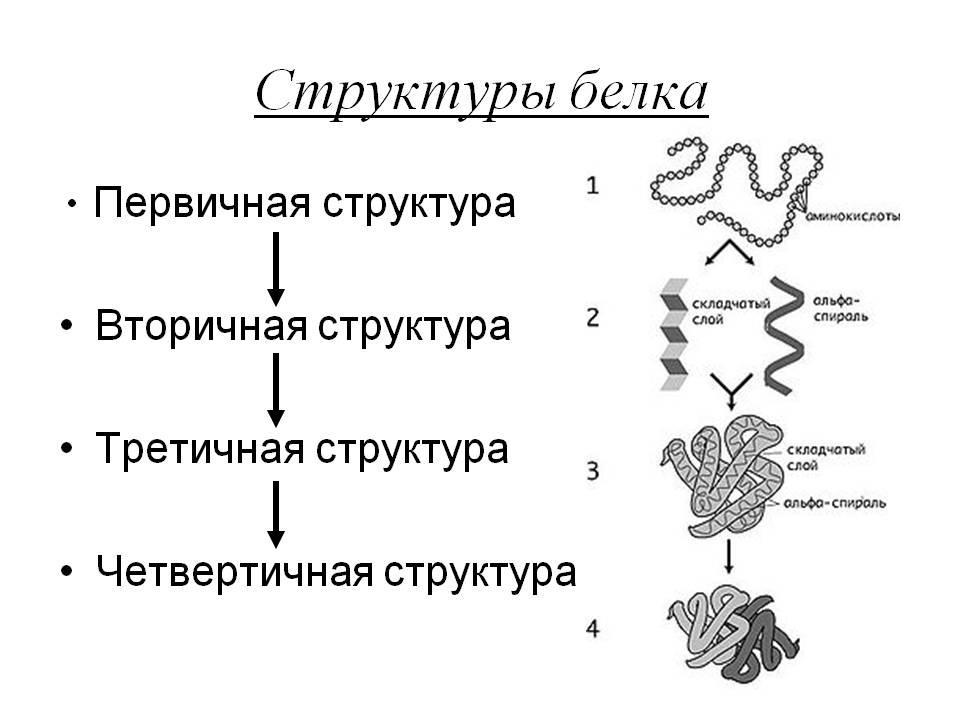
Четвертичная структура белка — это вариант того, как в пространстве укладываются отдельные полипептидные цепи, обладающие разной (может быть, одинаковой) первичной, вторичной и третичной структурой.
Вторичная структура белка представляет собой складчатый слой (альфа-спираль).
Почти все белковые молекулы могут сохранять свою биоактивность. Это значит, что они выполняют свойственные им функции исключительно в узком температурном диапазоне и в узком диапазоне кислотности среды.
В случаях, когда температура повышается или кислотность изменяется до экстремальных показателей, при добавлении гидрофобных агентов, к примеру, органических растворителей, увеличении концентрации солей, происходит изменения в структуре белков. Эти изменения становятся причиной денатурации — белок теряет свою естественную пространственную структуру.
При этом, разрушения первичной структуры белка не происходит.
Если исходить из структуры, то четвертичная структура белка — макромолекула. Множество функциональных белков состоит из полипептидных цепей, соединенных друг с другом несколькими главновалентными цепями. При этом ковалентные связи не наблюдаются.
Отдельную полипептидную цепь называют протомером, мономером или субъединицей, которая не отличается высокой функциональной активностью.
Эта способность появляется у белка при определенном варианте пространственного объединения мономеров. В результате возникает новое качество, не характерное для мономерного белка. Образующаяся в итоге молекула называется олигомером.
Специфика олигомерных белков
У олигомерных белков отмечаются следующие свойства:
К примеру, молекула гемоглобина включает две альфа- и две бета-полипептидные цепи. У этой молекулы форма тетрамера: это значит, что в ее состав входят 4 полипептидные цепи, регулярно взаимодействующие.
Каждая из этих цепей окружает специализированную группу гема-пигмента, которые отвечает за окрашивание крови в красный цвет. Молекула гемоглобина может подвергаться обратной диссоциации при определенных условиях. Формирование такого процесса происходит в результате влияния разрыва водородных связей. В случае, если мочевина и соли удаляются, исходная молекула гемоглобина подвергается автоматической ассоциации.
Стандартный пример олигомерной молекулы — вирус табачной мозаики, отличающийся гигантской молекулой. Длина этого вируса достигает 300 нм. Белковые частицы со спиралеобразной структурой (в ней содержится свыше 130 витков) нанизываются вокруг молекулы РНК.
У вируса есть невероятная способность: полная регенерация или восстановление четвертичной структуры. При этом наблюдается восстановление всех ее физических параметров и биологических функций.
Особенности функционирования четвертичной структуры
Внутри последовательности аминокислот есть информация, реализуемая на всех уровнях организации структуры молекулы белка.
У многих ферментов отмечается четвертичная структура. К примеру, фосфорилаза состоит из двух идентичных субъединиц, которые, в свою очередь, состоят из двух пептидных цепей. Из этого следует, что молекула — тетрамер. У отдельных субъединиц не наблюдается особенная каталитическая активность.
У любого регуляторного фермента — четвертичная структура и высокая скорость требуемых химических реакций в клетке.
Четвертичная структура белка довольно стабильна, хотя в отдельных случаях подвергается денатурации и последующему восстановлению (если выполняются некоторые условия вроде температуры, наличия катализаторов и др).
Характеристики четвертичной структуры белка
Для нескольких сотен белков четвертичная структура полностью расшифрована, хотя остается еще много белков с нерасшифрованной структурой. У этой структуры есть определенные характеристики:
Все вышеописанное позволяет говорить о существовании четвертичной структуры белка низшего порядка. У каждого белка — собственная уникальная структура и специализированные функции. Если человек постигнет структуру всех белков, то это даст возможность понять, как функционируют живые организмы. В результате такого научного поиска:
Некоторые ученые считают, что существует пятый уровень организации структуры белка. Имеются в виду полифункциональные макромолекулярные комплексы.
Ассоциат представляет собой макромолекулярный белковый комплекс.
В этом случае ферменты — метаболоны и олигомеры. Они отвечают за катализацию всего пути превращений субстрата в синтетазы высших кислот, дыхательную цепь и пируватдегидрогеназный комплекс.
Говоря о структуре белка кратко, на основе описанного выше, можно утверждать, что взаимодействие между отдельными молекулами внутри четвертичной структуры белка открывает возможности для изменений ее пространственной структуры.
Конформация — расположение атомов и групп молекул органического вещества, которое обусловлено возможностями вращения этих молекул вокруг ковалентных связей.
Эти изменения — основа биологической активности белковых полимеров.
Фиброин
Свойства
Фиброин является гетеродимером, образованным двумя белковыми цепями. Его первичная структура состоит из повторяющейся аминокислотной последовательности (Gly-Ser-Gly-Ala-Gly-Ala) n.
В свою очередь, повторяющиеся аминокислотные последовательности образуют антипараллельные складчатые β-слои, связанные водородными связями. Эта структура обуславливает высокий предел прочности нитей паутин и шелка. Более прочный, чем кевлар, фиброин вдобавок ещё и высоко эластичен. Эти качества делают его материалом, применяемым в различных областях, включая биомедицину и текстильное производство.
Структуры
Структура белка
По вторичной структуре белка семейство кератинов разделяется на две группы:
Для первичной структуры α-кератинов характерно большое содержание цистеина и множество дисульфидных связей.
В отличие от α-кератинов поперечные дисульфидные связи между соседними полипептидными цепями у β-кератинов отсутствуют. В полипептидной цепи каждый второй элемент — глицин. Характерно повторение последовательности «GSGAGA».
Для α-кератинов основным структурным компонентом являются цилиндрические микрофибриллы диаметром 75 А, состоящие из спирализованных, скрученных попарно протофибрилл.
Строение белков. Структуры белков
Структуры белков: первичная, вторичная, третичная и четвертичная
Белки
Название «белки» происходит от способности многих из них при нагревании становиться белыми. Название «протеины» происходит от греческого слова «первый», что указывает на их важное значение в организме. Чем выше уровень организации живых существ, тем разнообразнее состав белков.
Белки образуются из аминокислот, которые соединяются между собой ковалентной – пептидной связью: между карбоксильной группой одной аминокислоты и аминогруппой другой. При взаимодействии двух аминокислот образуется дипептид (из остатков двух аминокислот, от греч. пептос – сваренный). Замена, исключение или перестановка аминокислот в полипептидной цепи вызывает возникновение новых белков. Например, при замене лишь одной аминокислоты (глутамина на валин) возникает тяжелая болезнь – серповидно-клеточная анемия, когда эритроциты имеют другую форму и не могут выполнять свои основные функции (перенос кислорода). При образовании пептидной связи отщепляется молекула воды. В зависимости от количества аминокислотных остатков выделяют:
– олигопептиды (ди-, три-, тетрапептиды и т. п.) – содержат до 20 аминокислотных остатков;
– полипептиды – от 20 до 50 аминокислотных остатков;
– белки – свыше 50, иногда тысячи аминокислотных остатков
По физико-химическим свойствам различают белки гидрофильные и гидрофобные.
Существуют четыре уровня организации белковой молекулы – равноценные пространственные структуры (конфигурации, конформации) белков: первичная, вторичная, третичная и четвертичная.
Первичная структура
Первичная структура белков является простейшей. Имеет вид полипептидной цепи, где аминокислоты связаны между собой прочной пептидной связью. Определяется качественным и количественным составом аминокислот и их последовательностью.
Вторичная структура
Вторичная структура образована преимущественно водородными связями, которые образовались между атомами водорода NH-группы одного завитка спирали и кислорода СО-группы другого и направлены вдоль спирали или между параллельными складками молекулы белка. Белковая молекула частично или целиком скручена в α-спираль или образует β-складчатую структуру. Например, белки кератина образуют α-спираль. Они входят в состав копыт, рогов, волос, перьев, ногтей, когтей. β-складчатую имеют белки, которые входят в состав шелка. Извне спирали остаются аминокислотные радикалы (R-группы). Водородные связи значительно более слабые, чем ковалентные, но при значительном их количестве образуют довольно прочную структуру.
Функционирование в виде закрученной спирали характерно для некоторых фибриллярных белков – миозин, актин, фибриноген, коллаген и т. п.
Третичная структура
Третичная структура белка. Эта структура постоянна и своеобразна для каждого белка. Она определяется размером, полярностью R-групп, формой и последовательностью аминокислотных остатков. Полипептидная спираль закручивается и укладывается определенным образом. Формирование третичной структуры белка приводит к образованию особой конфигурации белка – глобулы (от лат. globulus – шарик). Его образование обуславливается разными типами нековалентных взаимодействий: гидрофобные, водородные, ионные. Между остатками аминокислоты цистеина возникают дисульфидные мостики.
Гидрофобные связи – это слабые связи между неполярными боковыми цепями, которые возникают в результате взаимного отталкивания молекул растворителя. При этом белок скручивается так, что гидрофобные боковые цепи погружены вглубь молекулы и защищают ее от взаимодействия с водой, а снаружи расположены боковые гидрофильные цепи.
Третичную структуру имеет большинство белков – глобулины, альбумины и т. п.
Четвертичная структура
Четвертичная структура белка. Образуется в результате объединения отдельных полипептидных цепей. В совокупности они составляют функциональную единицу. Типы связей разные: гидрофобные, водородные, электростатические, ионные.
Электростатические связи возникают между электроотрицательными и электроположительными радикалами аминокислотных остатков.
Для одних белков характерно глобулярное размещение субъединиц – это глобулярные белки. Глобулярные белки легко растворяются в воде или растворах солей. К глобулярным белкам принадлежит свыше 1000 известных ферментов. К глобулярным белкам относятся некоторые гормоны, антитела, транспортные белки. Например, сложная молекула гемоглобина (белка эритроцита крови) является глобулярным белком и состоит из четырех макромолекул глобинов: двух α-цепей и двух β-цепей, каждая из которых соединена с гемом, содержащим железо.
Для других белков характерно объединение в спиральные структуры – это фибриллярные (от лат. fibrilla – волоконце) белки. Несколько (от 3 до 7) α–спиралей свиваются вместе, подобно волокнам в кабеле. Фибриллярные белки нерастворимы в воде.
Белки делят на простые и сложные.
Простые (протеины)
Состоят только из остатков аминокислот. К простым белкам относят глобулины, альбумины, глутелины, проламины, протамины, пистоны. Альбумины (например, альбумин сыворотки крови) растворимы в воде, глобулины (например, антитела) нерастворимы в воде, но растворимы в водных растворах некоторых солей (хлорид натрия и т. п.).
Сложные (протеиды)
Включают в состав, кроме остатков аминокислот, соединения другой природы, которые называются простетическою группой. Например, металлопротеиды – это белки, содержащие негеминовое железо или связанные атомами металлов (большинство ферментов), нуклеопротеиды – белки, соединенные с нуклеиновыми кислотами (хромосомы и т. п.), фосфопротеиды –белки, в состав которых входят остатки фосфорной кислоты (белки яичного желтка и т. п.), гликопротеиды –белки в соединении с углеводами (некоторые гормоны, антитела и т. п.), хромопротеиды – белки, содержащий пигменты (миоглобин и т. п.), липопротеиды – белки, содержащие липиды (входят в состав мембран).
Строение и функции белков
Белки (протеины) составляют 50% от сухой массы живых организмов.
Белки состоят из аминокислот. У каждой аминокислоты есть аминогруппа и кислотная (карбоксильная) группа, при взаимодействии которых получается пептидная связь, поэтому белки еще называют полипептидами.
Структуры белка
Первичная – цепочка из аминокислот, связанных пептидной связью (сильной, ковалентной). Чередуя 20 аминокислот в разном порядке, можно получать миллионы разных белков. Если поменять в цепочке хотя бы одну аминокислоту, строение и функции белка изменятся, поэтому первичная структура считается самой главной в белке.
Вторичная – спираль. Удерживается водородными связями (слабыми).
Третичная – глобула (шарик). Четыре типа связей: дисульфидная (серный мостик) сильная, остальные три (ионные, гидрофобные, водородные) – слабые. Форма глобулы у каждого белка своя, от нее зависят функции. При денатурации форма глобулы меняется, и это сказывается на работе белка.
Четвертичная – имеется не у всех белков. Состоит из нескольких глобул, соединенных между собой теми же связями, что и в третичной структуре. (Например, гемоглобин.)
Денатурация
Это изменение формы глобулы белка, вызванное внешними воздействиями (температура, кислотность, соленость, присоединение других веществ и т.п.)
Функции белков
Их очень много, например:
Еще можно почитать
Задания части 1
Выберите один, наиболее правильный вариант. Водородные связи между СО- и NН-группами в молекуле белка придают ей форму спирали, характерную для структуры
1) первичной
2) вторичной
3) третичной
4) четвертичной
Выберите один, наиболее правильный вариант. Четвертичная структура молекулы белка образуется в результате взаимодействия
1) участков одной белковой молекулы по типу связей S-S
2) нескольких полипептидных нитей, образующих клубок
3) участков одной белковой молекулы за счет водородных связей
4) белковой глобулы с мембраной клетки
Выберите один, наиболее правильный вариант. Последовательность и число аминокислот в полипептидной цепи – это
1) первичная структура ДНК
2) первичная структура белка
3) вторичная структура ДНК
4) вторичная структура белка
Выберите один, наиболее правильный вариант. Первичная структура белка образована связью
1) водородной
2) макроэргической
3) пептидной
4) ионной
Выберите один, наиболее правильный вариант. В основе образования пептидных связей между аминокислотами в молекуле белка лежит
1) принцип комплементарности
2) нерастворимость аминокислот в воде
3) растворимость аминокислот в воде
4) наличие в них карбоксильной и аминной групп
БЕЛКИ
1. Выберите три варианта. Белки в организме человека и животных
1) составляют бо́льшую часть организма по массе
2) начинают расщепляться в ротовой полости
3) не содержат фосфора в составе молекулы
4) могут откладываться в запас
5) в качестве ферментов ускоряют химические реакции
6) служат основным строительным материалом
2. Выберите три верных ответа из шести и запишите цифры, под которыми они указаны. Выберите только особенности строения белковой молекулы.
1) содержит атомы фосфора
2) состоит из аминокислот
3) мономеры удерживаются пептидными связями
4) состоит из одинаковых по строению мономеров
5) изменяет форму под действием температуры
6) четвертичная структура состоит из нескольких молекул
3. Выберите три верных ответа из шести и запишите цифры, под которыми они указаны. Какие из перечисленных ниже признаков относятся к характеристикам молекул белков?
1) состоят из нуклеотидов
2) выполняют только структурную и двигательную функции
3) могут иметь форму глобулы
4) содержат в составе азот и серу
5) всегда нерастворимы в воде
6) являются нерегулярными полимерами
БЕЛКИ КРОМЕ
1. Все перечисленные признаки, кроме двух, можно использовать при описании яичного белка альбумина. Определите два признака, «выпадающие» из общего списка, и запишите цифры, под которыми они указаны.
1) состоит из аминокислот
2) пищеварительный фермент
3) денатурирует обратимо при варке яйца вкрутую
4) мономеры связаны пептидными связями
5) молекула образует первичную, вторичную и третичную структуры
2. Все перечисленные ниже признаки, кроме двух, можно использовать для описания молекулы белка. Определите два признака, «выпадающих» из общего списка, и запишите цифры, под которыми они указаны.
1) состоит из нуклеотидов
2) может иметь форму глобулы
3) имеет третичную и четвертичную структуры
4) образуется в ядре
5) бывают глобулярные и фибриллярные
БЕЛКИ КРОМЕ РИС
1. Перечисленные ниже признаки, кроме двух, используются для описания строения, функций изображенного органического вещества. Определите два признака, «выпадающие» из общего списка, и запишите цифры, под которыми они указаны.
1) имеет структурные уровни организации молекулы
2) входит в состав клеточных стенок
3) является биополимером
4) служит матрицей при трансляции
5) состоит из аминокислот

2. Все перечисленные ниже признаки, кроме двух, используются для описания изображённой на рисунке структуры. Определите два признака, «выпадающие» из общего списка, и запишите цифры, под которыми они указаны.
1) вторичная структура молекулы белка
2) удерживается только пептидными связями
3) определяется методом рентгеноструктурного анализа
4) представляет собой глобулу
5) может выполнять ферментативные функции

3. Все перечисленные ниже характеристики, кроме двух, используют для описания изображенной на рисунке молекулы органического вещества клетки. Определите две характеристики, «выпадающие» из общего списка, и запишите цифры, под которыми они указаны.
1) денатурация
2) репликация
3) транскрипция
4) аминокислоты
5) водородные связи
СТРУКТУРЫ БЕЛКА
Установите соответствие между характеристикой и структурой белка: 1) первичная, 2) третичная. Запишите цифры 1 и 2 в порядке, соответствующем буквам.
А) молекула в форме глобулы или фибриллы
Б) строгая последовательность аминокислотных остатков
В) аминокислотные остатки соединены только пептидными связями
Г) имеет дисульфидные мостики между радикалами аминокислот
Д) при ее разрушении наступает необратимая денатурация
Е) пространственная конфигурация полипептидной цепи
ФЕРМЕНТАТИВНАЯ
1. Все приведенные ниже признаки, кроме двух, можно использовать для описания ферментов. Определите два признака, «выпадающих» из общего списка, и запишите цифры, под которыми они указаны.
1) входят в состав клеточных мембран и органоидов клетки
2) играют роль биологических катализаторов
3) имеют активный центр
4) оказывают влияние на обмен веществ, регулируя различные процессы
5) специфические белки
2. Выберите три верных ответа из шести и запишите цифры, под которыми они указаны. Ферменты – это вещества, которые
1) вырабатываются в железах внутренней секреции
2) являются белками
3) поступают в организм, как правило, вместе с пищей
4) являются в организме источником энергии
5) ускоряют протекание химических реакций
6) у человека выполняют свои функции при температуре около 36 градусов
ФУНКЦИИ БЕЛКОВ
Выберите три верных ответа из шести и запишите цифры, под которыми они указаны. Функциями белков в организме человека являются
1) строительная
2) передача наследственных признаков
3) защитная
4) запасающая
5) ферментативно-каталитическая
6) хранение генетической информации
ФУНКЦИИ БЕЛКОВ КРОМЕ
Все перечисленные характеристики используют для описания функций белков. Определите две характеристики, «выпадающие» из общего списка, и запишите цифры, под которыми они указаны.
1) регуляторная
2) двигательная
3) рецепторная
4) образуют клеточные стенки
5) служат коферментами

Рассмотрите рисунок с изображением полипептида и укажите (А) уровень его организации, (Б) форму молекулы и (В) вид взаимодействия, поддерживающий эту структуру. Для каждой буквы выберите соответствующий термин или соответствующее понятие из предложенного списка.
1) первичная структура
2) вторичная структура
3) третичная структура
4) взаимодействия между нуклеотидами
5) металлическая связь
6) гидрофобные взаимодействия
7) фибриллярная
8) глобулярная

Рассмотрите схему химического вещества. Укажите (А) название класса органических веществ, (Б) уровень организации полимерной молекулы и (В) название мономеров, из которых состоит данная молекула. Для каждой буквы выберите соответствующий термин из предложенного списка.
1) ДНК
2) белок
3) альфа-спираль
4) вторичная структура
5) третичная структура
6) аминокислоты
7) нуклеотиды
8) рибоза

Рассмотрите рисунок с изображением полипептида. Укажите (А) уровень его организации, (Б) мономеры, которые его образуют, и (В) вид химических связей между ними. Для каждой буквы выберите соответствующий термин или соответствующее понятие из предложенного списка.
1) первичная структура
2) водородные связи
3) двойная спираль
4) вторичная структура
5) аминокислота
6) альфа-спираль
7) нуклеотид
8) пептидные связи

Проанализируйте таблицу «Уровни организации белка». Для каждой ячейки, обозначенной буквой, выберите соответствующий термин из предложенного списка.
1) глобула
2) двойная спираль
3) эфирные
4) гидрофильные
5) пептидные
6) нитчатая
7) вторичная
8) четвертичная
Известно, что белки – нерегулярные полимеры, имеющие высокую молекулярную массу, строго специфичны для каждого вида организма. Выберите из приведенного ниже текста три утверждения, по смыслу относящиеся к описанию этих признаков, и запишите цифры, под которыми они указаны. (1) В состав белков входит 20 различных аминокислот, соединенных пептидными связями. (2) Белки имеют различное количество аминокислот и порядок их чередования в молекуле. (3) Низкомолекулярные органические вещества имеют молекулярную массу от 100 до 1000. (4) Они являются промежуточными соединениями или структурными звеньями – мономерами. (5) Многие белки характеризуются молекулярной массой от нескольких тысяч до миллиона и выше, в зависимости от количества отдельных полипептидных цепей в составе единой молекулярной структуры белка. (6) Каждый вид живых организмов имеет особый, только ему присущий набор белков, отличающий его от других организмов.



