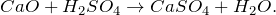Cao что это соль или кислота или оксид
Оксид кальция: способы получения и химические свойства
Оксид кальция CaO — бинарное неорганическое вещество . Белый, гигроскопичный. Тугоплавкий, термически устойчивый, летучий при очень высоких температурах. Проявляет основные свойства.
Относительная молекулярная масса Mr = 56,08; относительная плотность для тв. и ж. состояния d = 3,35; tпл ≈ 2614º C; tкип = 2850º C.
Способ получения
1. Оксид кальция получается при разложении карбоната кальция при температуре 900 — 1200º C. В результате разложения образуется оксид кальция и углекислый газ:
2. В результате взаимодействия гидрида кальция и кислорода при температуре 300 — 400º С образуется оксид кальция и вода:
3. Оксид кальция можно получить сжиганием кальция в в кислороде при температуре выше 300º С:
2Ca + O2 = 2CaO
Химические свойства
1. Оксид кальция реагирует с простыми веществами :
Оксид кальция реагирует с углеродом (коксом) при температуре 1900 — 1950º С и образует угарный газ и карбид кальция:
CaO + 3C = CaC2 + CO
2. Оксид кальция взаимодействует со сложными веществами:
2.1. Оксид кальция взаимодействует с кислотами:
2.1.1. О ксид кальция с разбавленной соляной кислотой образует хлорид кальция и воду:
CaO + 2HCl = CaCl2 + H2O
2.1.2. Оксид кальция вступает во взаимодействие с разбавленной плавиковой кислотой с образованием фторида кальция и воды:
CaO + 2HF = CaF2↓ + H2O
2.1.3. Оксид кальция вступает в реакцию с разбавленной фосфорной кислотой, образуя фосфат кальция и воду:
2.2. Оксид кальция реагирует с оксидами:
2.2.1. Оксид кальция при комнатной температуре реагирует с углекислым газом с образованием карбоната кальция:
CaO + CO2 = CaCO3
2.2.2. Взаимодействуя с оксидом кремния при 1100 — 1200º С оксид кальция образует силикат кальция:
CaO + SiO2 = CaSiO3
2.3. Оксид кальция взаимодействует с водой при комнатной температуре, образуя гидроксид кальция:
Оксид кальция
| Оксид кальция | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | Оксид кальция |
| Химическая формула | CaO |
| Физические свойства | |
| Состояние (ст. усл.) | твердое |
| Молярная масса | 56.077 г/моль |
| Плотность | 3.37 г/см³ |
| Термические свойства | |
| Температура плавления | 2570 °C |
| Температура кипения | 2850 °C |
| Молярная теплоёмкость (ст. усл.) | 42.05 Дж/(моль·К) |
| Энтальпия образования (ст. усл.) | -635,09 кДж/моль |
Окси́д ка́льция (окись кальция, негашёная и́звесть или «кипелка», «кираби́т») — белое кристаллическое вещество, формула CaO.
Негашёная известь и продукт её взаимодействия с водой — Ca(OH)2 (гашёная известь или «пушонка») находят обширное использование в строительном деле.
Содержание
Получение
В промышленности оксид кальция получают термическим разложением известняка (карбоната кальция):
Также оксид кальция можно получить при взаимодействии простых веществ:
или при термическом разложении гидроксида кальция и кальциевых солей некоторых кислородсодержащих кислот:
Физические свойства
Оксид кальция — белое кристаллическое вещество, кристаллизующееся в кубической гранецентрированной кристаллической решетке, по типу хлорида натрия.
Химические свойства
Оксид кальция относится к основным оксидам. Растворяется в воде с выделением энергии, образуя гидроксид кальция:

Как основный оксид реагирует с кислотными оксидами и кислотами, образуя соли:

Применение
Основные объёмы используются в строительстве при производстве Силикатного кирпича. Раньше известь, так же использовали в качестве известкового цемента — при смешивании с водой, оксид кальция переходит в гидроксид, который далее, поглощая из воздуха углекислый газ, сильно твердеет, превращаясь в карбонат кальция. Однако в настоящее время известковый цемент при строительстве жилых домов стараются не применять, так как полученные строения обладают способностью впитывать и накапливать сырость.
Категорически недопустимо использование известкового цемента при кладке печей — из-за термического разложения и выделения в воздух удушливого диоксида углерода.
Некоторое применение также находит в качестве доступного и недорогого огнеупорного материала — плавленный оксид кальция имеет некоторую устойчивость к воздействию воды, что позволяет его использовать в качестве огнеупора там, где применение более дорогих материалов нецелесообразно.
В небольших количествах оксид кальция также используется в лабораторной практике для осушения веществ, которые не реагируют с ним.
В промышленности для удаления диоксида серы из дымовых газов, как правило используют 15% водяной раствор. В результате реакции гашеной извести и диоксида серы получается гипс СaСO3 и СаSO4. В эксперементальных установках добивались показателя в 98% отчиски дымовых газов от диоксида серы.
Так же используется в «самогреющей» посуде. Контейнер с небольшим количеством оксида кальция помещается между двух стенок стакана, а при прокалывании капсулы с водой начинается реакция с выделением тепла.
Формула оксидов.
Классификация оксидов.
По классификации оксидов, солеобразующими оксидами являются те оксиды, которые могут взаимодействовать с кислотами либо основаниями с возможностью появления соответствующей соли и воды. Солеобразующими оксидами называют:
Основные оксиды, зачастую образующиеся из металлов со степенью окисления +1, +2. Могут реагировать с кислотами, с кислотными оксидами, с амфотерными оксидами, с водой (только оксиды щелочных и щелочно-земельных металлов). Элемент основного оксида становится катионом в образующейся соли. Na2O, CaO, MgO, CuO.
Примечание: металл менее активный, чем алюминий.
Амфотерные оксиды, образуют металлы со степенью окисления от +3 до +5 (к амфотерным оксидам относятся также BeO, ZnO, PbO, SnO). Реагируют с кислотами, щелочами, кислотными и основными оксидами.
При взаимодействии с сильной кислотой или кислотным оксидом проявляют основные свойства: ZnO + 2HCl → ZnCl2 + H2O
При взаимодействии с сильным основанием или основным оксидом проявляют кислотные свойства:
Несолеобразующие оксиды не вступают в реакцию ни с кислотами, ни с основаниями, а значит, солей не образуют. N2O, NO, CO, SiO.
В соответствии с номенклатурой ИЮПАК, названия оксидов складываются из слова оксид и названия второго химического элемента (с меньшей электроотрицательностью) в родительном падеже:
Если элемент может образовывать несколько оксидов, то в их названиях следует указать степень окисления элемента:
Можно использовать латинские приставки для обозначения числа атомов элементов, которые входят в молекулу оксида:
Часто используются также тривиальные названия некоторых оксидов:
CaO какой это оксид
Подскажите, CaO какой это оксид? К какому типу оксидов: основные, кислотные, амфотерные он относится? Расскажите об общих способах получения оксидов этого класса, а также об их характерных химических свойствах.
Основными называются такие оксиды, которым соответствуют основания. Они образованы металлами I и IIA групп, т.е. оксид кальция является основным (CaO какой это оксид).
Способы получения оксидов различны. Наиболее часто используют реакцию непосредственного соединения простого вещества с кислородом (при различных условиях):

Разложение при нагревании кислородных соединений: карбонатов, нитратов, гидроксидов также приводит к образованию оксидов:

При взаимодействии с кислотами основные оксиды образуют соль и воду:
Реакции основных и кислотных оксидов также приводит к образованию солей:
Cao что это соль или кислота или оксид
Химические свойства основных оксидов:
1. основ.оксид + кислота = соль + Н2О
2. основ.оксид + кисл.оксид = соль
Химические свойства кислотных оксидов:
1. кисл.оксид + основание = соль + Н2О
2. кисл.оксид + основ.оксид = соль
3. кисл.оксид + Н2О = кислота
ОСНОВАНИЯ – это сложные вещества, состоящие из ионов металла и гидроксид-ионов.
Химические свойства оснований:
1. основание + кислота = соль + Н2О
2. щелочь + кисл.оксид = соль + Н2О
3. щелочь + соль = новое основание + новая соль (↑ или ↓)
(2 KOH + CuCl 2 = Cu ( OH )2 ↓ + 2 KCl )
4. нерастворимое основание = оксид Ме + Н2О
это сложные вещества, которые имеют свойства и кислот, и оснований, и потому их формулы можно записывать в разных формах:
форма основания форма кислоты
КИСЛОТЫ – это сложные вещества, состоящие из ионов водорода и кислотных остатков.
1. кислота + основание = соль + Н2О
( HCl + NaOH = NaCl + H 2 O )
2. кислота + основ.оксид = соль + Н2О
3. кислота + соль = новая кислота + новая соль (↑ или ↓)
4. кислота + Ме = соль + Н2 (Ме до водорода, соль растворима)
СОЛИ – это сложные вещества, состоящие из ионов металла и кислотных остатков.
1. соль + щелочь = новое основание + новая соль (↑ или ↓)
( FeCl 3 +3 KOH = Fe ( OH )3 ↓ +3 KCl )
2. соль + кислота = новая кислота + новая соль (↑ или ↓)
3. соль + соль = новая соль + новая соль (↓)
( NaCl + AgNO 3 = AgCl ↓ + NaNO 3 )
4. соль + Ме = новая соль + другой Ме