Al2s3 с чем реагирует
Сульфид алюминия
| Сульфид алюминия | |
|---|---|
| Систематическое наименование | Сульфид алюминия |
| Хим. формула | Al2S3 |
| Рац. формула | Al2S3 |
| Состояние | твёрдое |
| Молярная масса | 150,158 г/моль |
| Плотность | 2,02 г/см³ |
| Температура | |
| • плавления | 1100 °C |
| • кипения | 1500 °C |
| Кристаллическая структура | тригональная, hP30 |
| Рег. номер CAS | 1302-81-4 |
| PubChem | 16684788 |
| Рег. номер EINECS | 215-109-0 |
| SMILES | |
| ChemSpider | 140154 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Сульфид алюминия (Сернистый алюминий) — сложное неорганическое вещество с химической формулой Al2S3.
Содержание
Описание
Сульфид алюминия — бескислородная соль белого цвета. Плавится без разложения под избыточным давлением азота, легко возгоняется. Окисляется на воздухе при прокаливании. Полностью гидролизуется водой, поэтому не может быть получен обменными реакциями в водных растворах. Разлагается сильными кислотами. Применяется как твердый источник чистого сероводорода.
Получение
Взаимодействие алюминия с расплавленной серой в отсутствие кислорода и влаги:
Химические свойства
1. Взаимодействие с водой:
2. Взаимодействие с разбавленной HCl:
3. Взаимодействие с кислородом в воздухе (700-800 °C):
Сульфид алюминия (Al2S3) Химическая структура, номенклатура, свойства
сульфид алюминия (Al2S3) представляет собой светло-серое химическое соединение, образованное в результате окисления металлического алюминия путем потери электронов последнего энергетического уровня и превращения в катион, а также из-за восстановления неметаллической серы путем завоевания электронов, образующихся из алюминия и превращения в анион.
С другой стороны, поскольку сульфид алюминия имеет реакционную способность с водой, это делает его элементом, который не имеет растворимости в указанном растворителе..
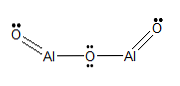
Химическая структура
Молекулярная формула
Структурная формула
— Ди трисульфид алюминия.
— Сульфид алюминия (III).
свойства
Химические соединения в основном проявляют два вида свойств: физические и химические.
Физические свойства
Молярная масса
плотность
Точка плавления
Растворимость в воде
Химические свойства
Одной из основных реакций сульфида алюминия является вода в качестве субстрата или основного реагента:
В этой реакции может наблюдаться образование гидроксида алюминия и сероводорода, если он находится в форме газа, или сероводорода, если он растворяется в воде в виде раствора. Его присутствие определяется запахом тухлых яиц.
Использование и приложения
В суперконденсаторах
Сульфид алюминия используется в производстве наносеточных структур, которые улучшают удельную площадь поверхности и электрическую проводимость таким образом, что могут быть достигнуты высокая емкость и плотность энергии, применимость которых применима для суперконденсаторов..
Действие оксида графена
Характеристики оксида графена в качестве носителя, а также высокая электропроводность и площадь поверхности делают нанорамбант Al2S3 быть электрохимически активным.
Кривые удельной емкости CV с четко определенными окислительно-восстановительными пиками подтверждают псевдо-емкостное поведение нанорамбутанов Al2S3 иерархическая, поддерживается в оксиде графена в 1М электролите NaOH. Значения удельной емкости CV, полученные из кривых: 168,97 при скорости сканирования 5 мВ / с..
Таким образом, электрохимический импеданс подтверждает псевдо-емкостную природу иерархического наногуммирующего электрода Al.2S3. Испытание на стабильность электрода показывает сохранение удельной емкости на 57,44% до 1000 циклов.
Результаты экспериментов свидетельствуют о том, что нанорамбутант Al2S3 Иерархический подходит для приложений суперконденсаторов.
Во вторичных литиевых батареях
С целью разработки литиевой вторичной батареи с высокой плотностью энергии, сульфид алюминия (Al2S3) в качестве активного материала.
Начальная разрядная емкость измеряется от Al2S3 было приблизительно 1170 мАч г-1 при 100 мА г-1. Это соответствует 62% теоретической емкости по сере.
Аль2S3 проявлял слабое удержание емкости в диапазоне потенциалов между 0,01 В и 2,0 В, главным образом из-за структурной необратимости процесса зарядки или извлечения Li..
Анализ XRD и K-XANES для алюминия и серы показал, что поверхность Al2S3 обратимо реагирует во время процессов загрузки и выгрузки, в то время как ядро Al2S3 показал структурную необратимость, потому что LiAl и Li2S были сформированы из Al2S3 в начальной загрузке, а затем они остались, как они были.
риски
— При соприкосновении с водой выделяет легковоспламеняющиеся газы, которые могут самовозгораться.
— Вызывает раздражение кожи.
— Вызывает серьезное раздражение глаз.
— Может вызвать раздражение дыхательных путей.
Информация может варьироваться между уведомлениями в зависимости от примесей, добавок и других факторов.
Первая помощь
Общее лечение
Обратиться к врачу, если симптомы не проходят.
Специальное лечение
Важные симптомы
ингаляция
Выведите жертву на улицу. Подача кислорода при затрудненном дыхании.
прием пищи
Администрирование один или два стакана воды и вызвать рвоту. Никогда не вызывайте рвоту и не дайте что-либо в рот человеку без сознания.
кожа
Промойте пораженный участок водой и мягким мылом. Удалить всю загрязненную одежду.
глаза
Вымойте глаза водой, часто мигая в течение нескольких минут. Снимите контактные линзы, если они есть, и продолжайте промывать.
Противопожарные меры
воспламеняемость
Средства пожаротушения
Реагирует с водой. Не используйте воду: используйте CO2, песок и порошок для тушения.
Боевая процедура
Используйте автономный дыхательный аппарат с полной защитой лица. Носите одежду, чтобы избежать контакта с кожей и глазами.
Сульфид алюминия (Al2S3): структура, свойства
Содержание:
В сульфид алюминия (К2S3) представляет собой светло-серое химическое соединение, образованное окислением металлического алюминия за счет потери электронов последнего энергетического уровня и превращения в катион, а также за счет восстановления неметаллической серы за счет получения электронов, данных алюминием, и превращения анион.
С другой стороны, поскольку сульфид алюминия реагирует с водой, это делает его элементом, который не растворяется в указанном растворителе.
Химическая структура
Молекулярная формула
Структурная формула
— Трисульфид ди алюминия.
— Сульфид алюминия (III).
Свойства
Химические соединения в основном обладают двумя классами свойств: физическими и химическими.
Физические свойства
Молярная масса
Плотность
Температура плавления
Растворимость воды
Химические свойства
В этой реакции можно наблюдать образование гидроксида алюминия и сероводорода, если он находится в форме газа, или сероводорода, если он растворен в воде в виде раствора. Их присутствие можно определить по запаху тухлых яиц.
Использование и приложения
В суперконденсаторах
Действие оксида графена
Характеристики оксида графена в качестве носителя, а также высокая электропроводность и площадь поверхности делают нанорамбутан Al2S3 быть электрохимически активным.
CV-кривые удельной емкости с четко определенными пиками окислительно-восстановительного потенциала подтверждают псевдемкостное поведение нанорамбутана Al.2S3 иерархическая, проводимая в оксиде графена в 1М электролите NaOH. Значения удельной емкости CV, полученные из кривых, составляют: 168,97 при скорости сканирования 5 мВ / с.
Таким образом, электрохимический импеданс подтверждает псевдоемкостный характер иерархического нанорамбутанового электрода Al2S3. Тест на стабильность электрода показывает сохранение 57,84% удельной емкости в течение до 1000 циклов.
Экспериментальные результаты показывают, что нанорамбутан Al2S3 иерархический подходит для применений суперконденсаторов.
Во вторичных литиевых батареях
С целью разработки вторичной литиевой батареи с высокой плотностью энергии сульфид алюминия (Al2S3) в качестве активного материала.
Измеренная начальная разрядная емкость Al2S3 оно составляло примерно от 1170 мАч г-1 до 100 мА г-1. Это соответствует 62% теоретической емкости по сульфиду.
Аль2S3 показали плохое сохранение емкости в диапазоне потенциалов от 0,01 В до 2,0 В, в основном из-за структурной необратимости процесса зарядки или удаления Li.
Анализ XRD и K-XANES для алюминия и серы показал, что поверхность Al2S3 обратимо реагирует в процессах загрузки и разгрузки, а алюминиевый сердечник2S3 показали структурную необратимость, поскольку LiAl и Li2S были образованы из Al2S3 при первоначальной разрядке, а затем оставался как есть.
Риски
— При контакте с водой выделяет легковоспламеняющиеся газы, которые могут самопроизвольно загореться.
— Вызывает раздражение кожи.
— Вызывает серьезное раздражение глаз.
— Может вызывать раздражение дыхательных путей.
Информация в уведомлениях может различаться в зависимости от примесей, добавок и других факторов.
Порядок оказания первой помощи
Общее лечение
Если симптомы не исчезнут, обратитесь за медицинской помощью.
Особый уход
Важные симптомы
Вдыхание
Выведите жертву на улицу. Дайте кислород, если дыхание затруднено.
Проглатывание
Дайте один или два стакана воды и вызовите рвоту. Никогда не вызывайте рвоту и не давайте что-либо человеку без сознания.
Кожа
Промойте пораженный участок водой с мягким мылом. Снимите загрязненную одежду.
Глаза
Промойте глаза водой, часто моргая в течение нескольких минут. Снимите контактные линзы, если они у вас есть, и продолжайте полоскание.
Противопожарные меры
Воспламеняемость
Средства пожаротушения
Реагирует с водой. Не используйте воду: используйте CO2, песок и порошок для тушения.
Боевой порядок
Надевайте полностью защищающий лицо автономный дыхательный аппарат. Носите одежду, чтобы избежать контакта с кожей и глазами.
Ссылки
150 красивых фраз на годовщину свадьбы и жениха
Алюминий
Алюминий является самым распространенным металлом в земной коре. Свойства алюминия позволяют активно применять в составе металлоконструкций: он легкий, мягкий, поддается штамповке, обладает высокой антикоррозийной устойчивостью.
Для алюминия характерна высокая химическая активность, отличается также высокой электро- и теплопроводностью.
Основное и возбужденное состояние
При переходе атома алюминия в возбужденное состояние 2 электрона s-подуровня распариваются, и один электрон переходит на p-подуровень.
Природные соединения
Получение
Химические свойства
При комнатной температуре реагирует с галогенами (кроме фтора) и кислородом, покрываясь при этом оксидной пленкой.
Al + Br2 → AlBr3 (бромид алюминия)
При нагревании алюминий вступает в реакции с фтором, серой, азотом и углеродом.
Al + F2 → (t) AlF3 (фторид алюминия)
Al + S → (t) Al2S3 (сульфид алюминия)
Al + N2 → (t) AlN (нитрид алюминия)
Al + C → (t) Al4C3 (карбид алюминия)
С помощью алюминотермии получают Fe, Cr, Mn, Ca, Ti, V, W.
Оксид алюминия
Проявляет амфотерные свойства: реагирует и с кислотами, и с основаниями.
Al2O3 + NaOH + H2O → Na[Al(OH)4] (тетрагидроксоалюминат натрия)
Гидроксид алюминия
Проявляет амфотерные свойства. Реагирует и с кислотами, и с основаниями. Вследствие нерастворимости гидроксид алюминия не реагирует с солями.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
2.2.3. Характерные химические свойства алюминия.
Взаимодействие алюминия с простыми веществами
с кислородом
При контакте абсолютно чистого алюминия с воздухом атомы алюминия, находящиеся в поверхностном слое, мгновенно взаимодействуют с кислородом воздуха и образуют тончайшую, толщиной в несколько десятков атомарных слоев, прочную оксидную пленку состава Al2O3, которая защищает алюминий от дальнейшего окисления. Невозможно и окисление крупных образцов алюминия даже при очень высоких температурах. Тем не менее, мелкодисперсный порошок алюминия довольно легко сгорает в пламени горелки:
с галогенами
Алюминий очень энергично реагирует со всеми галогенами. Так, реакция между перемешанными порошками алюминия и йода протекает уже при комнатной температуре после добавления капли воды в качестве катализатора. Уравнение взаимодействия йода с алюминием:
С бромом, представляющим собой тёмно-бурую жидкость, алюминий также реагирует без нагревания. Образец алюминия достаточно просто внести в жидкий бром: тут же начинается бурная реакция с выделением большого количества тепла и света:
Реакция между алюминием и хлором протекает при внесении нагретой алюминиевой фольги или мелкодисперсного порошка алюминия в заполненную хлором колбу. Алюминий эффектно сгорает в хлоре в соответствии с уравнением:
с серой
При нагревании до 150-200 о С или после поджигания смеси порошкообразных алюминия и серы между ними начинается интенсивная экзотермическая реакция с выделением света:
— сульфид алюминия
с азотом
При взаимодействии алюминия с азотом при температуре около 800 o C образуется нитрид алюминия:
с углеродом
Взаимодействие алюминия со сложными веществами
с водой
Как уже было сказано выше, стойкая и прочная оксидная пленка из Al2O3 не дает алюминию окисляться на воздухе. Эта же защитная оксидная пленка делает алюминий инертным и по отношению к воде. При снятии защитной оксидной пленки с поверхности такими методами, как обработка водными растворами щелочи, хлорида аммония или солей ртути (амальгирование), алюминий начинает энергично реагировать с водой с образованием гидроксида алюминия и газообразного водорода:
с оксидами металлов
После поджигания смеси алюминия с оксидами менее активных металлов (правее алюминия в ряду активности) начинается крайне бурная сильно-экзотермическая реакция. Так, в случае взаимодействия алюминия с оксидом железа (III) развивается температура 2500-3000 о С. В результате этой реакции образуется высокочистое расплавленное железо:
Данный метод получения металлов из их оксидов путем восстановления алюминием называется алюмотермией или алюминотермией.
с кислотами-неокислителями
Взаимодействие алюминия с кислотами-неокислителями, т.е. практически всеми кислотами, кроме концентрированной серной и азотной кислот, приводит к образованию соли алюминия соответствующей кислоты и газообразного водорода:
2Аl 0 + 6Н + = 2Аl 3+ + 3H2 0 ;
с кислотами-окислителями
-концентрированной серной кислотой
Взаимодействие алюминия с концентрированной серной кислотой в обычных условиях, а также низких температурах не происходит вследствие эффекта, называемого пассивацией. При нагревании реакция возможна и приводит к образованию сульфата алюминия, воды и сероводорода, который образуется в результате восстановления серы, входящей в состав серной кислоты:
— концентрированной азотной кислотой
Концентрированная азотная кислота в обычных условиях также пассивирует алюминий, что делает возможным ее хранение в алюминиевых емкостях. Так же, как и в случае с концентрированной серной, взаимодействие алюминия с концентрированной азотной кислотой становится возможным при сильном нагревании, при этом преимущественно параллельно протекают реакции:
— разбавленной азотной кислотой
Взаимодействие алюминия с разбавленной по сравнению с концентрированной азотной кислотой приводит к продуктам более глубокого восстановления азота. Вместо NO в зависимости от степени разбавления могут образовываться N2O и NH4NO3:
со щелочами
Алюминий реагирует как с водными растворами щелочей:
так и с чистыми щелочами при сплавлении:
В обоих случаях реакция начинается с растворения защитной пленки оксида алюминия:
В случае водного раствора алюминий, очищенный от защитной оксидной пленки, начинает реагировать с водой по уравнению:
Образующийся гидроксид алюминия, будучи амфотерным, реагирует с водным раствором гидроксида натрия с образованием растворимого тетрагидроксоалюмината натрия: