Acinetobacter johnsonii что это такое в мазке у мужчин
Инфекции, вызываемые Kingella
, MD, FACP, Charles E. Schmidt College of Medicine, Florida Atlantic University;
, MD, FACP, Wellington Regional Medical Center
Kingella – принадлежат семейству Neisseriaceae, короткие, неподвижные, грамотрицательные коккобациллы, которые существуют в парах или в виде коротких цепей. Организмы растут медленно и прихотливы. Kingella обитают в человеческих дыхательных путях и являются редкой причиной болезни у человека.
Болезни, вызванные Kingella
Наиболее распространенными проявлениями заболеваний, вызванных K. kingae являются:
Редкие проявления включают пневмонию, эпиглоттит, менингит, абсцессы и глазные инфекции.
Наиболее распространенная инфекция с поражением костно-мышечной системы – септический артрит, который наиболее часто поражает крупные, несущие вес суставы, особенно колено и лодыжку.
При остеомиелите чаще всего поражаются кости нижних конечностей. Начало заболевания протекает без явных симптомов и установление диагноза часто запаздывает. Может развиться гематогенная инвазия межпозвонковых дисков (cпондилодисцит), по большей части в поясничной области.
Эндокардит, вызванный Kingella, регистрируется во всех возрастных группах. Эндокардит может поражать естественные или искусственные клапаны сердца. Kingella входит в группу HACEK Инфекции, вызываемые бактериями группы HACEK Группа HACEK включает слабовирулентные, грамотрицательные микроорганизмы, которые прежде всего вызывают эндокардит. Лечение проводится с использованием антибиотиков. Группа HACEK – неподвижные. Прочитайте дополнительные сведения ( Haemophilus aphrophilus и H. parainfluenzae, Aggregatibacter, Cardiobacterium, Eikenella, Kingella), в которую включены прихотливые грамотрицательные бактерии, способные вызвать эндокардит.
Диагноз инфекций Kingella устанавливается на основании выделения культуры возбудителя в биологических жидкостях или тканях, которые предположительно были инфицированы.
Лечение инфекций, вызываемых Kingella
Пенициллин или цефалоспорин
Организмы Kingella в целом чувствительны к различным пенициллинам и цефалоспоринам. Однако необходимо определение чувствительности к антибактериальным препаратам, чтобы провести адекватную терапию. Другими эффективными препаратами являются аминогликозиды, триметоприм/сульфаметоксазол, тетрациклины, эритомицин и фторхинолоны.
Acinetobacter (ацинетобактер)

Acinetobacter — повсеместно встречающаяся бактерия. У здоровых людей, в частности, он обитает на коже, также выделяется из кишечника.
Ацинетобактер — причина внутрибольничных инфекций
Ацинетобактер в анализах кала
Ацинетобактер в систематике бактерий
Род Acinetobacter относится к семейству Moraxellaceae, которое входит в порядок Pseudomonadales, класс гамма-протеобактерии (γ proteobacteria), тип протеобактерии (Proteobacteria), царство бактерии.
В род ацинетобактер включены следующие виды: Acinetobacter albensis, Acinetobacter antiviralis, Acinetobacter apis, Acinetobacter baumannii, Acinetobacter baylyi, Acinetobacter beijerinckii, Acinetobacter bereziniae, Acinetobacter bohemicus, Acinetobacter boissieri, Acinetobacter bouvetii, Acinetobacter brisouii, Acinetobacter calcoaceticus, Acinetobacter endosymbiont of Anopheles claviger, Acinetobacter celticus, Acinetobacter courvalinii, Acinetobacter defluvii, Acinetobacter dispersus, Acinetobacter endosymbiont of Anopheles claviger, Acinetobacter endosymbiont of Culex pipiens, Acinetobacter endosymbiont of Nilaparvata lugens, Acinetobacter equi, Acinetobacter gandensis, Acinetobacter genospecies, Acinetobacter gerneri, Acinetobacter glutaminasificans, Acinetobacter guangdongensis, Acinetobacter guillouiae, Acinetobacter gyllenbergii, Acinetobacter haemolyticus, Acinetobacter halotolerans, Acinetobacter harbinensis, Acinetobacter idrijaensis, Acinetobacter indicus, Acinetobacter johnsonii, Acinetobacter junii, Acinetobacter kookii, Acinetobacter kyonggiensis, Acinetobacter lactucae, Acinetobacter larvae, Acinetobacter lwoffii, Acinetobacter marinus, Acinetobacter modestus, Acinetobacter movanagherensis, Acinetobacter nectaris, Acinetobacter oleivorans, Acinetobacter oryzae, Acinetobacter parvus, Acinetobacter plantarum, Acinetobacter populi, Acinetobacter proteolyticus, Acinetobacter psychrotolerans, Acinetobacter puyangensis, Acinetobacter qingfengensis, Acinetobacter radioresistens, Acinetobacter refrigeratoris, Acinetobacter rhizosphaerae, Acinetobacter rudis, Acinetobacter schindleri, Acinetobacter seohaensis, Acinetobacter septicus, Acinetobacter soli, Acinetobacter tandoii, Acinetobacter tjernbergiae, Acinetobacter towneri, Acinetobacter ursingii, Acinetobacter variabilis, Acinetobacter venetianus, Acinetobacter vivianii, Acinetobacter xiamenensis.
Ряд видов, а именно: Acinetobacter baumannii, Acinetobacter calcoaceticus, Acinetobacter nosocomialis, Acinetobacter pittii объединены в отдельную группу Acinetobacter calcoaceticus/baumannii complex.
Антибиотики, активные и неактивные в отношении ацинетобактера
Необходимо отметить, что ацинетобактер отличаются высокой и поливалентной резистентностью к антибиотикам, что крайне затрудняет эффективное лечение больных (Гельфанд Е.Б. и др.).
A. Противомикробные средства из имеющих описание в данном справочнике
Ацинетобактер устойчив к: рокситромицину.
Б. Иные противомикробные препараты
Ацинетобактер умеренно чувствителен к цефалоспоринам IV поколения: цефепиму, цефпирому и другим (Яковлев С.В.).
Из карбапенемов в отношении ацинетобактера активны меропенем, имипенем, биапенем и панипенем. Эртапенем, наоборот, не активен (Белобородов В.Б.).
Ацинетобактер имеет высокий уровень устойчивости к фторхинолонам. В частности, к ципрофлоксацину на территории России в отделениях реанимации частота устойчивости варьирует от 13 до 53% (Сидоренко С.В.).
По мнению С.В. Яковлева, при выявленном возбудителе, препаратам первого ряда для лечения инфекции (мочевыводящих путей у больных пожилого возраста) ацинетобактера, являются фторхинолоны, в качестве альтернативных средств рекомендуются карбапенемы, амикацин и цефалоспорины IV поколения.
Ацинетобактер чувствителен к сульбактаму и к комбинации амоксициллин + сульбактам (Царапкин Г.Ю. и др.).
Виды ацинетобактера в общем резистентны к азтреонаму (R. de Groot).
Acinetobacter calcoaceticus и рассеянный склероз
E. Cekanaviciute и др. из США в своём исследовании* установили связь микробиоты толстой кишки человека и рассеянного склероза. Они определили, что у больных рассеянным склерозом количество Acinetobacter calcoaceticus и Akkermansia muciniphila повышено, а Parabacteroides distasonis снижено. Было высказано предположение, что состав микробиоты кишечника может стимуловать развитие рассеянного склероза. Определенные виды бактерий способны модулировать иммунный ответ в организме, подстегивая или подавляя заболевание.
*Cekanaviciute E et al. Gut bacteria from multiple sclerosis patients modulate human T cells and exacerbate symptoms in mouse models / Proc. Natl. Acad. Sci. USA, vol. 114, no. 40, 10713–10718, doi: 10.1073/pnas.1711235114.
Acinetobacter johnsonii что это такое в мазке у мужчин
Acinetobacter spp. относится к микроорганизмам, свободно живущим в окружающей среде (сапрофиты), па различных объектах в лечебных учреждениях, в воде, пищевых продуктах. Помимо этого Acinetobacter spp. выделяется из различных биотопов (например, с кожи, слизистой оболочки) человека.
Присутствие Acinetobacter spp. в биоматериалах от пациента, находящегося в стационаре, может быть как следствием колонизации слизистых оболочек и кожи, так и причиной инфекционных осложнений различной локализации. У 25% взрослых людей имеет место колонизация кожи, а у 7% детей колонизированы верхние дыхательные пути. Acinetobacter spp., так же как и P. aeruginosa, способна месяцами находиться на различных объектах окружающей среды в жизнеспособном состоянии.
Кроме того, Acinetobacter spp. устойчива ко многим бактерицидным растворам, например к хлоргексидину.
По данным CDC (NNIS), за последние 20 лет значение неферментирующих грамотрицательных палочек рода Acinetobacter как возбудителей НКИ значительно позросло во всем мире. При хирургических вмешательствах Acinetobacter spp. выделяют из гнойных ран в 2,1 % случаев. Вид A. baumannii составляет 80% всех видов этого рода, ответственных за ЕКИ, и поэтому выделение любого другого вида этого рода дает основание предполагать, что имеет место коптам и нация исследуемого биоматериала.
Повторное выделение Acinetobacter spp. из любых биоматериалов важно для исключения контаминации или колонизации и, в конечном счете, для правильной трактовки полученных результатов микробиологических исследований. Следует заметить, что наиболее часто Acinetobacter spp. выделяют при пневмонии (Acinetobacter spp. составляет 6,9% всех возбудителей при этой локализации), особенно если ей предшествовала колонизация слизистых верхних дыхательных путей. Летальность при пневмонии, обусловленной Acinetobacler spp., составляет 40-64%.
Наряду с другими микробами-оппортунистами (такими, как S. maltophilia) Acinetobacter spp. отличается высокой резистентностью к большинству антимикробных препаратов, хотя имеются существенные различия по антибиотикорезистентности штаммов в разных странах и регионах. В настоящее время, по сообщениям различных авторов, большинство штаммов А. baumannii резистентно ко многим классам антимикробных препаратов. Фторхинолоны, тигециклин, цефтазидим, триметоприм/сульфаметоксазол, доксициклин, имипенем, меропенем, дорипенем, полимиксин В и колистин до недавнего времени считались активными против госпитальных штаммов A. baumannii.
Быстрое развитие резистентности A. baumannii к большинству антибиотиков (МDR-Acinetobacter) регистрируется во всем мире. Сульбактам имеет более высокую природную бактерицидную активность против MDR-Acinetobacter в сравнении с тазобактамом и клавулановой кислотой, в то же время отмечается увеличение резистентности и к сульбактаму. Комбинация имипенема с амикацином в исследованиях in vitro показала синергизм в отношении MDR-штаммов, тогда как in vivo эффект менее выражен. Комбинация фторхинолонов с амикацином приемлема, когда имеет место низкая МПК фторхинолонов для госпитальных штаммов A baumannii.
При выделении штаммов МDR-A. baumannii применяют комбинацию полимиксипа В с рифампицином (или с имипенемом, или с азитромицином). Имеется небольшое количество исследований по применению тигециклина для лечения инфекций, обусловленных A. baumannii, но уже сейчас использование этого антибиотика связывают с постепенным увеличением резистентности. По данным из Германии, резистентность к тигециклину среди A. baumannii составляет 6%, тогда как к кол истину — 2,8%.
По данным SENTRY 2001-2004 гг. (30 стран Европы), доля штаммов Acinetobacter spp., резистентных к имипенему, меропенему, ампициллину/сульбактаму и полимиксину В составляет 26,3, 29,6, 51,6 и 2,7% соответственно. Важно отметить, что даже в странах с низким уровнем резистентности феномен распространения MDR-, XDR- или PDR-штаммов A. baumannii пока неясен. Одним из факторов риска MDR-A. baumannii считается назначении карбапенемов и цефалоспоринов III поколения.
Кроме того, риск связан с искусственной вентиляцией легких (ИВЛ), длительным пребыванием в реанимации, оперативным вмешательством, контаминацией окружающих объектов.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Бактериальный уретрит
Исследования по поводу наличия бактериального уретрита можно пройти в нашей «Клинике ABC». Действующие специалисты и набор высокотехнологичного оборудования помогут упростить процесс диагностики. Квалифицированные врачи при необходимости разработают эффективные методы лечения, подобранные с учетом индивидуальных особенностей организма пациента. Это позволит навсегда избавиться от неприятного заболевания.
Общая информация
Болезнь возникает в результате поражении мочеполовой системы патогенной микрофлорой.
Бактериальный уретрит у мужчин и женщин может развиваться в результате попадания в организм различных инфекционных возбудителей – кишечной палочки, стрептококков, энтерококков.
У женщин болезнь может осложняться при попадании патогенов во влагалище.
Как возникает заболевание?
Патологический процесс возникает на фоне различных нарушений или провоцирующих факторов, которые заставляют сапрофитные группы бактерий активно размножаться. Данные микроорганизмы не являются патогенными, однако при наличии определенных факторов (снижение иммунитета) микроорганизмы способны оказывать негативное воздействие на организм человека.
В некоторых случаях спровоцировать патологию могут специфические разновидности микроорганизмов – хламидии, гонококки, трихомонады.
Крымкин Юрий Михайлович
Заведующий урологическим отделением, врач-уролог, хирург-андролог
Кармолиев Рустам Рафикович
Корнеева Лариса Николаевна
Врач-уролог высшей категории, кандидат медицинских наук
Классификация патологии
Данная форма болезни подразделяется на 2 основных типа – первичный и вторичный неспецифический бактериальный уретрит. Первый тип болезни возникает у людей, не имевших ранее инфекционных заболеваний.
Первые симптомы могут возникать спустя месяц после проникновения патогенных микроорганизмов. Заболеванию подвержены как взрослые, так и дети.
Симптомы бактериального уретрита
Патология имеет различный инкубационный период – от нескольких дней до 1,5 месяцев. Следует учитывать, что симптомы и лечение бактериального уретрита у мужчин и женщин будут отличаться.
Заболевание у мужчин может быть вызвано различными травмами и повреждениями, а также неправильным проведением гигиенических процедур.
Чем отличается женский уретрит от мужского?
Симптомы и лечение бактериального уретрита у мужчин и женщин отличаются из-за особенностей строения уретры.
Признаки болезни у женщин могут отсутствовать длительное время и не вызывать никаких дискомфортных ощущений в отличие от мужчин.
Однако в обоих случаях развитие бактериального уретрита сопровождается болевыми ощущениями в области живота или лобка.
Диагностика
Диагностика позволяет определить наличие болезни даже при отсутствии какой-либо симптоматики.
Лечение болезни
При выявлении причин подбирается терапия. При этом чем лечить бактериальный уретрит, определяет лечащий специалист. Терапия проводится амбулаторно.
В качестве терапевтических мер рекомендуется на весь период лечения отказаться от половых контактов и вредных привычек – алкоголя, табака.
Также следует придерживаться правил питания. Для этого из рациона следует исключить жареное, соленое, жирное, острое и копченое.
Для местного лечения патологии специалист назначает инстилляции. Проводится катетеризация с применением антисептических растворов, способных оказать угнетающее действие на бактерии.
Осложнения
При неадекватной терапии или ее полном отсутствии воспалительный процесс может перейти в хроническую форму. При этом все признаки могут на время затихать. Однако при наличии провоцирующих факторов болезнь может резко развиться, сопровождаемая выраженными симптомами.
Бактериальный неспецифический уретрит у мужчин может спровоцировать развитие уретропростатита, а также стать причиной других осложненных проявлений в области мочеполовой системы.
У женщин патология может привести к возникновению цистита, воспалительным реакциям во влагалище или половых железах. В тяжелых случаях, а также при восходящем типе заболевания процесс может привести к частичному или полному бесплодию. Поэтому при первых признаках болезни необходимо незамедлительно обратиться к гинекологу или инфекционисту.
Профилактические меры
Чтобы избежать возникновения бактериального уретрита у мужчин и женщин следует строго придерживаться правил профилактики.
Наш медицинский сервис «Клиника ABC» предлагает пройти все необходимые процедуры по устранению заболевания в кратчайшие сроки. Специально разработанные индивидуальные схемы терапии помогут быстро и эффективно избавиться от болезни навсегда. Весь процесс проводится строго в условиях конфиденциальности. Запись на прием к специалисту осуществляется по предоставленным номерам.
Ацинетобактер
Автор: врач – клинический фармаколог Трубачева Е.С.
Автор: врач – клинический фармаколог Трубачева Е.С.
Если еще каких-то 7 лет назад ацинетобактер была зверем, о котором знали реаниматологи крупных больниц да клинические фармакологи, то менее пяти лет назад ситуация кардинально изменилась – теперь про ацинетку знают все, кто в том или ином виде работает в стационарах. Она очень быстро заместила собой всю предыдущую внутрибольничную микрофлору и фактически вышла на первый план самых проблемных внутрибольничных микробов, заняв чуть ли не основную нишу ВБИ.
Автор сразу хотел бы предупредить, что речь здесь пойдет не столько об Acinetobacter baumannii, сколько о семействе ацинетобактеров, ибо клиническую значимость имеет не только вышеупомянутый возбудитель.
Ацинетобактеры являются представителями тройки основных опасных возбудителей согласно определению ВОЗ. Двух других представителей из этого списка мы уже обсудили: это синегнойная палочка и энтеробактерии (клебсиелла, кишечная палочка, энтерококки). Именно для этой могучей тройки в первую очередь и должны разрабатываться новые антибиотики, но пока с этим как-то не очень.
Микробиологические аспекты
Ацинетобактер (или ацинетка, как любит обзывать ее автор), является фактически «кровной родней» другого общеизвестного неферментера – синегнойной палочки. Но, в отличие от синегнойки, природно-устойчивого ацинетобактера вам могут принести прямо с улицы. То есть в природе имеются штаммы, и в очень большом количестве, которые изначально природно-устойчивы фактически ко всему арсеналу имеющихся в медицине антибиотиков. А еще таких же, но уже внутрибольничных мутантов не менее «удачно» выращивают в отделениях с высокой частотой использования антибактериальных препаратов. И это при том, что принести такого микроба в больницу, а также занести его в больного, может вообще любой человек, так как изначально ацинетка, как и синегнойка, является почвенным микробом, а потому горшки с цветами, садоводы-огородники, зимой растящие рассаду, летом ковыряющиеся на даче, а потом, нормально не отмыв руки, начинающие перевязывать раны или менять катетеры, да просто посетители с пылью на ботинках – все они в каждый момент времени приносят в больницы миллиарды подобных микробов. И это как раз то, о чем автор упоминал в разговоре о клебсиелле – вывести ацинетку, в отличие от синегнойки, несопоставимо труднее. Напомню, синегнойка предпочитает мокрую теплую грязь, поэтому ее проще отсечь от заноса в чистые отделения и внутри самой больницы проще выбить. А теперь представьте, чего будет стоить избавиться от пыли, комнатных растений, любителей-огородников и ломящихся, теперь уже даже в реанимации, посетителей. Практически нереально, если это только не ламинарный бокс.
Поэтому будем изучать врага в лицо
Общее представление о том, что из себя представляют дикие и непуганые антибиотиками ацинетобактеры, можно составить на EUCAST. Для тех, кто никогда не пользовался данным ресурсом, небольшая подсказка – тыкаем мышкой (или пальцем, смотря откуда читаете этот опус) в плашку «Species», выбираем один из 25-ти ацинетобактеров и наслаждаемся изучением. Общую антибиотикочувствительность семейства Acinetobacter spp. можно рассмотреть тут. Небольшое пояснение для тех, кто здесь впервые, – клинически значимыми минимальными подавляющими концентрациями (MIC), которыми можно и нужно пользоваться в клинической практике (а также как маркер того, какие антибиотики будут работать, а какие нет – их MIC указаны с чисто исследовательскими целями), являются показатели, отмеченные синими клеточками. На эти же показатели настроены аппараты для определения антибиотикочувствительности, с помощью которых продемонстрированы антибиотикограммы в наших статьях.
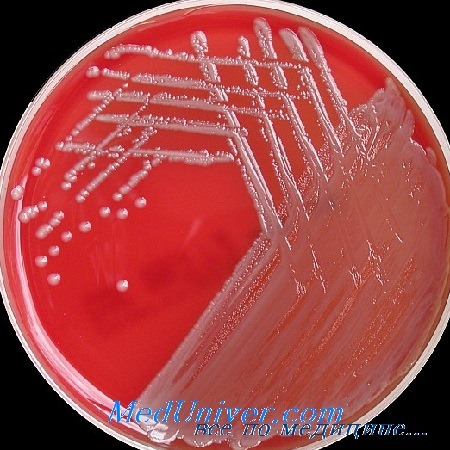
Теперь посмотрим на, можно сказать, типичных представителей семейства Acinetobacter spp. Необходимо отметить, что продемонстрированные ниже возбудители выделены из ран, полученных в результате ДТП в летнее время, причем у пациентов, которые длительное время не лечились антибиотиками, то есть оба зверя являются дикими.
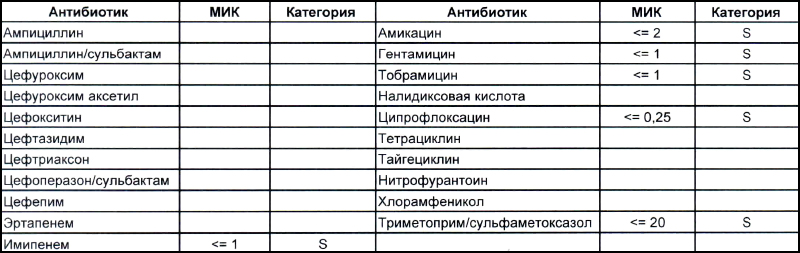
На первом фото лечащему врачу повезло, так как ему достался возбудитель, чувствительный ко всему возможному арсеналу антибиотиков, которые в принципе могут повлиять на данный микроб.
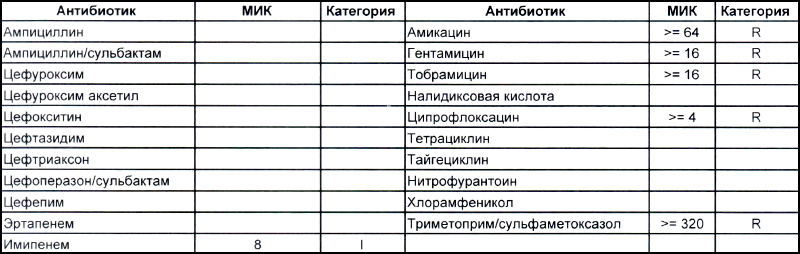
На второй антибиотикограмме возбудитель тоже получен из раны, ни разу не леченной антибиотиками, а также сам больной длительное время ничего антибактериального не употреблял. Данный случай очень хорошо демонстрирует то, что мы обсудили раньше, – только по антибиотикограмме в случае ацинеток трудно сказать, внутрибольничный возбудитель вызвал гнойно-воспалительный процесс или дикий уличный.
В научно-исследовательском институте, который может провести генетическое исследование возбудителя, смогут выяснить полностью, дикий это штамм или внутрибольничный, а мы, работающие на земле, скорее всего, не ответим на этот вопрос. Правда, у нас теперь СК все про всех знает, и автор уже давно ждет, когда очередного несчастного еще и в такого рода заражении обвинят.
Следует отметить, что обе эти картинки не отменяют факта наличия внутрибольничного заражения как первым штаммом (горшки с цветами помним?), так и вторым, в который под действием использующихся в больнице антибиотиков может выродиться первый. Ациентка, как и предыдущие обсуждаемые возбудители ВБИ, так же не имеет крылышек и ножек, ее точно так же переносят на руках и плохо обработанном медицинском оборудовании (эндоскопы, точнее, бронхоскопы, это просто бич крупных стационаров). Поэтому только внутриведомственный микробиологический надзор и работа над соблюдением санэпидрежима помогает удержать и эту зверюгу в хоть каких-то приемлемых рамках.
Клинические аспекты
Что способен вызвать ацинетобактер?
В общем, как вы можете видеть, ацинетка способна загубить на корню любой врачебный труд, так как инфекции, ей вызванные, имеют высокий процент летальности у пациентов, имеющих факторы риска развития подобной инфекции.
К факторам риска относятся:
Чем лечить?
Хороший вопрос. Точно такой же, как «чем лечить внутрибольничную клебсиеллу», которым мы задавались ранее.
Как вы могли убедиться, лечить ацинетку эмпирически (а это возможно только при тщательном внутрибольничном мониторинге), и даже с использованием диско-диффузионного метода, не очень-то и получится. Точнее, не получится совсем. Нужны аппаратные методы диагностики, чтобы точно знать, с чем вы имеете дело. И внутрибольничный мониторинг тоже крайне необходим, особенно если неферментеры сеются массово, чтобы знать — заполз ли возбудитель с улицы или уже свой зверинец развели. Во втором случае только мыть-мыть и еще раз мыть всю больницу полностью, а не только одно отделение, а также переходить на полностью одноразовые расходники, и к аппаратам ИВЛ тоже. Автор понимает, что при этих словах или в монитор захочется плюнуть, или помидором тухлым швырнуть, благо сезон пока не закончен.
Так как лечить?
В рамках клинических рекомендаций по той нозологии, которая у вашего пациента имеется, выложенных здесь, всегда только комиссионно, с привлечением клинических фармакологов и клинических микробиологов. И мойте руки после каждого подобного пациента очень тщательно — это ваша личная техника безопасности.